Lý 11 Bài 14: Dòng điện trong chất điện phân
Để sản xuất nhôm cần phải có một nguồn điện năng dồi dào. Vậy quy trình luyện nhôm đã dựa trên hiện tượng nào để đòi hỏi cần nhiều điện như vậy? Sau khi học xong bài học các em sẽ trả lời được câu hỏi trên, mời các em cùng theo dõi nhé.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Thiết bị điện li
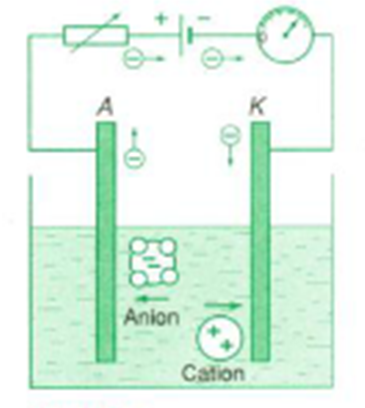
Trong dung dịch, các hợp chất hoá học như axit, bazơ và muối bị phân li thành các nguyên tử tích điện gọi là ion; ion có thể chuyển động tự do trong dung dịch và trở thành hạt tải điện.
1.2. Bản chất dòng điện trong chất điện phân
- Dòng điện trong chất điện phân là dòng chuyển dời có hướng của các ion trong điện trường.
- Chất điện phân không dẫn điện tốt bằng kim loại.
- Dòng điện trong chất điện phân không chỉ tải điện lượng mà còn tải cả vật chất đi theo. Tới điện cực chỉ có các electron có thể đi tiếp, còn lượng vật chất đọng lại ở điện cực, gây ra hiện tượng điện phân
-
Ion dương (Cation) -> Catot
-
Ion âm (Anion) -> Anot
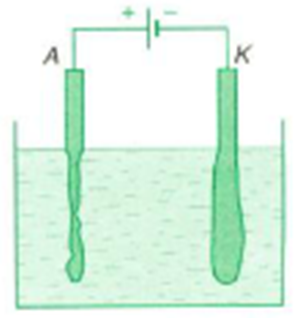
1.3. Các hiện tượng diễn ra ở điện cực. Hiện tượng dương cực tan
-
Các ion chuyển động về các điện cực có thể tác dụng với chất làm điện cực hoặc với dung môi tạo nên các phản ứng hoá học gọi là phản ứng phụ trong hiện tượng điện phân.
-
Hiện tượng dương cực tan xảy ra khi các anion đi tới anôt kéo các ion kim loại của điện cực vào trong dung dịch
1.4. Các định luật Fa-ra-đây
a) Định luật Faraday thứ nhất:
- Khối lượng vật chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với điện lượng chạy qua bình đó.
+ Công thức: \(m = k.q\)
-
k: đương lượng điện hóa của chất được giải phóng
b) Định luật Faraday thứ hai:
- Đương lượng điện hoá k của một nguyên tố tỉ lệ với đương lượng gam \(\frac{A}{n}\) của nguyên tố đó. Hệ số tỉ lệ \(\frac{1}{F}\) , trong đó F gọi là số Faraday.
+ Công thức: \(k = \frac{1}{F}.\frac{A}{n}\)
-
F = 96500 C/mol
-
A: khối lượng phân tử
-
n: hóa trị
- Kết hợp hai định luật Fa-ra-đây, ta được công thức Fa-ra-đây
+ Công thức: \(m = \frac{1}{F}.\frac{A}{n}.I.t\)
-
m: khối lượng chất được giải phóng (g)
- F = 96500 C/mol
- A: khối lượng phân tử
- n: hóa trị
- I: cường độ dòng điện
- t: thời gian dòng điện chạy qua.
1.5. Ứng dụng của hiện tượng điện phân
Hiện tượng điện phân có nhiều ứng dụng trong thực tế sản xuất và đời sống như luyện nhôm, tinh luyện đồng, điều chế clo, xút, mạ điện, đúc điện, …
a) Luyện nhôm
-
Dựa vào hiện tượng điện phân quặng nhôm nóng chảy.
-
Bể điện phân có cực dương là quặng nhôm nóng chảy, cực âm bằng than, chất điện phân là muối nhôm nóng chảy, dòng điện chạy qua khoảng \({10^4}A\)
b) Mạ điện
-
Bể điện phân có anôt là một tấm kim loại để mạ, catôt là vật cần mạ.
-
Chất điện phân thường là dung dịch muối kim loại để mạ. Dòng điện qua bể mạ được chọn một cách thích hợp để đảm bảo chất lượng của lớp mạ.
2. Bài tập minh họa
2.1. Dạng 1: Tìm thời gian cần thiết để bóc được lớp kim loại
Người ta muốn bóc một lớp đồng dày \(d = 10 \mu m\) trên một bản đồng diện tích \(S = 1cm^2\) bằng phương pháp điện phân. Cường độ dòng điện là 0,010A. Tính thời gian cần thiết để bóc được lớp đồng. Cho biết đồng có khối lượng riêng là \(p = 8 900 kg/m^3\)
Hướng dẫn giải
Sử dụng công thức \(m = \rho .V\) (với \(\rho\) là khối lượng riêng của chất)
Với: \(S = 1c{m^2} = {10.10^{ - 4}}{m^2};d = 10\mu m = {10.10^{ - 6}}m\)
Khối lượng của đồng phải bóc đi là:
\(m = \rho V = \rho Sd = {8900.10^{ - 4}}{.10.10^{ - 6}} = 8,{9.10^{ - 6}}kg\)
Áp dụng công thức Faraday để suy ra thời gian cần thiết để bóc lớp đồng
Ta có \(m = \frac{1}{{96500}}.\frac{A}{n}.I.t \Rightarrow t = \frac{{96500.m.n}}{{A.I}}\)
Với \(A = 64g = {64.10^{ - 3}}kg;n = 2;I = {10^{ - 2}}A\)
\( \Rightarrow t = \frac{{96500.8,{{9.10}^{ - 6}}.2}}{{{{64.10}^{ - 3}}{{.10}^{ - 2}}}} = 2683,9s = 44,73{\rm{ phút}}\)
Vậy thời gian cần thiết để bóc lớp đồng là 44,73 phút.
2.2. Dạng 2: Xác định điện trở suất của dung dịch
Tốc độ chuyển động có hướng của ion \(Na^+\) và \(Cl^-\) trong nước có thể tính theo công thức:\(v = \mu E\), trong đó E là cường độ điện trường, \(\mu\) có giá trị lần lượt là \(4,5.10^{-8} m^2/(V.s)\) và \(6,8.10^{-8} m^2/(V.s)\). Tính điện trở suất của dung dịch NaCl nồng độ 0,1 mol/l, cho rằng toàn bộ các phân tử NaCl đều phân li thành ion.
Hướng dẫn giải
- Điện trở của khối vật dẫn:
\(R = \frac{U}{I} = \rho \frac{l}{S} \Rightarrow \rho = \frac{{U.S}}{{I.l}}\)
Mà \(E = \frac{U}{l}\)
⇒ \(\rho = \frac{{E.S}}{I}\)
- Cường độ dòng điện qua dung dịch:
\(\begin{array}{l}
I = \frac{{\Delta q}}{{\Delta t}} = \frac{{{N_{hat}}.\left| e \right|}}{{\Delta t}}\\
{N_{hat}} = {N_{NaCl}} = {n_{NaCl}}.{N_A} = {C_M}.{V_{NaCl}}.{N_A}\\
{V_{NaCl}} = S.({v_{N{a^ + }}} + {v_{C{l^ - }}}).\Delta t = S.E.({\mu _{N{a^ + }}} + {\mu _{C{l^ - }}}).\Delta t
\end{array}\)
\( \Rightarrow I = \frac{{{C_M}.S.E.({\mu _{N{a^ + }}} + {\mu _{C{l^ - }}}).\Delta t.{N_A}.\left| e \right|}}{{\Delta t}}\)
- Cường độ dòng điện qua dung dịch:
\(\begin{array}{l}
I = \frac{{\Delta q}}{{\Delta t}} = \frac{{{N_{hat}}.\left| e \right|}}{{\Delta t}}\\
{N_{hat}} = {N_{NaCl}} = {n_{NaCl}}.{N_A} = {C_M}.{V_{NaCl}}.{N_A}\\
{V_{NaCl}} = S.({v_{N{a^ + }}} + {v_{C{l^ - }}}).\Delta t = S.E.({\mu _{N{a^ + }}} + {\mu _{C{l^ - }}}).\Delta t
\end{array}\)
\( \Rightarrow I = \frac{{{C_M}.S.E.({\mu _{N{a^ + }}} + {\mu _{C{l^ - }}}).\Delta t.{N_A}.\left| e \right|}}{{\Delta t}}\)
Với \({C_{{M_{NaCl}}}} = 0,1mol/l = 100mol/{m^3}\)
\(\begin{array}{l}
\Rightarrow \frac{{E.S}}{I} = \frac{1}{{{C_M}.{N_A}.\left| e \right|.({\mu _{N{a^ + }}} + {\mu _{C{L^ - }}})}} = \rho \\
\Rightarrow \rho = \frac{1}{{100.6,{{023.10}^{23}}.1,{{6.10}^{ - 19}}.(4,{{5.10}^{ - 8}} + 6,{{8.10}^{ - 8}})}} = 0,918\Omega m \approx 1\Omega m
\end{array}\)
Vậy, điện trở suất của dung dịch NaCl ≈ 1 \(\Omega m\)
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Một bình điện phân chứa dung dịch đồng sunphat (CuSO4 ) có anot bằng đồng. Biết khối lượng mol nguyên tử của đồng (Cu) là A = 63,5g/mol và hoá trị n = 2. Nếu cường độ dòng điện chạy qua bình này là 1,93A thì trong 0,5 giờ, khối lượng của catot tăng thêm là
Câu 2: Một bình điện phân chứa dung dịch bạc nitrat (AgNO3) có anot bằng bạc. Biết bạc (Ag) có khối lượng mol nguyên tử A = 108g/mol và hoá trị n = 1. Nếu hiệu điện thế giữa hai cực của bình là 10V và sau 16 phút 5 giây có 4,32g bạc bám vào anot thì điện trở của bình là
Câu 3: Một bình điện phân chứa dung dịch bạc nitrat (AgNO3) có anot bằng bạc. Biết bạc (Ag) có khối lượng mol nguyên tử A = 108g/mol và hoá trị n = 1. Nếu hiệu điện thế giữa hai cực của bình là 10V và sau 16 phút 5 giây có 4,32g bạc bám vào anot thì điện trở của bình là
Câu 4: Để mạ đồng hai mặt của một tấm sắt có diện tích mỗi mặt là 25cm2, người ta dung nó làm catot của một bình điện phân có anot bằng đồng nhúng trong dung dịch CuSO4 rồi cho dòng điện có cường độ I = 1A chạy qua trong thời gian 1 giờ 20 phút. Biết ACu = 64, nCu = 2 và khối lượng riêng của đồng là ρCu = 8,9g/cm3. Bề dày của lớp mạ là
Câu 5: Một bộ nguồn điện gồm 30 pin mắc thành ba nhóm nối tiếp, mỗi nhóm có 10 pin mắc song song; mỗi pin có suất điện động E0 và điện trở trong r = 0,6Ω. Mắc một bình điện phân đựng dung dịch CuSO4 có điện trở R = 205Ω vào hai cực của bộ nguồn nói trên. Biết anot của bình điện phân bằng đồng và sau 50 phút có 0,013g đồng bám vào catot. Suất điện động E0 bằng
3.2. Bài tập trắc nghiệm
Câu 1: Một bình điện phân chứa dung dịch muối niken với hai điện cực bằng niken. Biết đương lượng điện hoá của niken là 0,3.10-3g/C và khối lượng niken bám vào catot trong 1 giờ khi cho dòng điện có cường độ I chạy qua bình này là 5,4g. Cường độ dòng điện chạy qua bình bằng
A. 0,5A
B. 5A
C. 15A
D. 1,5A
Câu 2: Cho đương lượng điện hoá của niken là k = 3.10-4g/C. Khi cho một điện lượng 10C chạy qua bình điện phân có anot làm bằng niken, thì khối lượng niken bám vào catot là:
A. 0,3.10-4g
B. 3.10-4g
C. 0,3.10-4g
D. 10,3.10-4g
Câu 3: Chọn phương án đúng
A. Mạ điện dựa trên nguyên lí của hiện tượng dương cực tan trong quá trình điện phân
B. Acquy hoạt động dựa trên nguyên lí hoạt động của bình điện phân
C. Tụ điện hoá học có nguyên lí làm việc dựa trên nguyên lí của hiện tượng dương cực tan
D. Pin điện dựa trên nguyên lí của hiện tượng dương cực tan
Câu 4: Tìm phát biểu sai
A. Dòng điện trong chất điện phân là dòng của các electron tự do và dương khi có điện trường
B. Dòng điện trong chất điện phân là dòng chuyển dời có hướng của các ion dương cùng chiều điện trường và ion âm theo theo chiều ngược với chiều điện trường
C. Khi có điện trường đặt vào chất điện phân, các ion dương và âm vãn chuyển động hỗn loạn nhưng có định hướng theo phương của điện trường. tính định hướng phụ thuộc vào cường độ điện trường
D. Trong chất điện phân, khi có dòng điện tác dụng bởi điện trường ngoài sẽ có phản ứng phụ tại các điện cực
Câu 5: Tìm phát biểu sai
A. Trong chất điện phân, các chuyển động nhiệt của ion dương và ion âm có thể va chạm vào nhau và xảy ra quá trình tái hợp
B. Số ion dương và âm được tạo ra trong chất điện phân phụ thuộc vào nồng độ của dung dịch.
C. Điện trở của bình điện phân tăng khi nhiệt độ tăng
D. Số ion dương và âm được tạo ra trong chất điện phân phụ thuộc vào nhiệt độ của dung dịch.
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Dòng điện trong chất điện phân Vật lý 11 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Qua bài giảng Dòng điện trong chất điện phân này, các em cần hoàn thành 1 số mục tiêu mà bài đưa ra như :
-
Trả lời được câu hỏi thế nào là chất điện phân, hiện tượng điện phân, nêu được bản chất dòng điện trong chất điện phân
-
Phát biểu được định luật Fa-ra-day về điện phân.
-
Mô tả được hiện tượng dương cực tan
Tham khảo thêm
- doc Lý 11 Bài 13: Dòng điện trong kim loại
- doc Lý 11 Bài 15: Dòng điện trong chất khí
- doc Lý 11 Bài 16: Dòng điện trong chân không
- doc Lý 11 Bài 17: Dòng điện trong chất bán dẫn
- doc Lý 11 Bài 18: Thực hành: Khảo sát đặc tính chỉnh lưu của điốt bán dẫn và đặc tính khuếch đại của Tranzito