10 đề thi giữa HK1 môn Hóa 9 năm 2019 có đáp án
Bộ tài liệu 10 đề kiểm tra giữa học kì 1 Hóa 9 được biên soạn nhằm giúp các em ôn tập và nắm vững thêm kiến thức. Hi vọng bộ tài liệu sẽ giúp ích các em học tập thật tốt. Mời các em cùng tham khảo.
Mục lục nội dung

1. Đề thi giữa HK1 môn Hóa học 9 số 1
TRƯỜNG THCS HÀ HUY TẬP
ĐỀ KIỂM TRA GIỮA HK1
MÔN: HÓA HỌC - LỚP 9
NĂM HỌC 2019- 2020
Câu 1(2 điểm). Bazơ là gì? Nêu các tính chất hóa học của bazơ?
Mỗi tính chất minh họa bằng phản ứng hóa học?
Câu 2(2 điểm). Cho các chất sau : CaO, SO2 , HCl ,NaOH , P2O5 , H2S , Na2O , Ca(OH)2 .
Hãy cho biết chất nào thuộc oxit bazơ , oxit axit , bazơ , axit , muối
Câu 3(2 điểm). Trình bày phương pháp hóa học nhận biết các dung dịch đựng trong các lọ mất nhãn sau:
HCl , NaOH , Na2SO4 , NaCl .
Câu 4(2 điểm). Hoàn thành sơ đồ phản ứng sau:
S → SO2 → SO3 → H2SO4 → MgSO4.
Câu 5(2 điểm). Hòa tan 8(g) CuO hoàn toàn vào 200(g) dung dịch HCl .
a) Tính khối lượng muối thu được.
b) Tính nồng độ phần trăm dung dịch HCl cần dùng.
------ HẾT ------
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
2. Đề thi giữa HK1 môn Hóa học 9 số 2
TRƯỜNG THCS NGUYỄN CHÍ THANH
ĐỀ KIỂM TRA GIỮA HK1
MÔN: HÓA HỌC - LỚP 9
NĂM HỌC: 2019- 2020
II. Trắc nghiệm (4 điểm)
Câu 1: Số chất khí tạo ra khi cho dung dịch H2SO4 loãng lần lượt tác dụng với: Fe, Na2CO3, NaHCO3, FeO, Na2SO3 là:
A.2 B.3
C.4 D.5.
Câu 2: Có 3 lọ mất nhãn, mỗi lọ đựng một trong các chất rắn sau: BaCl2, NaHCO3, BaSO3. Thuốc thử dùng để nhận biết cả 3 chất là:
A.dung dịch HCl
B.dung dịch NaOH
B.dung dịch Na2CO3
D.dung dịch H2SO4
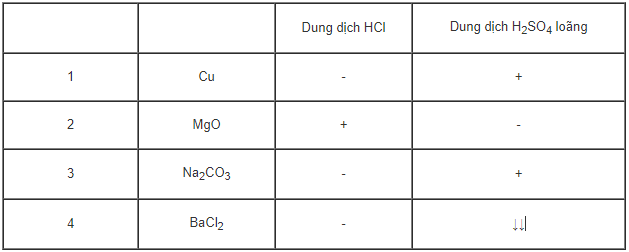
Câu 3: Khi so sánh tính chất 2 dung dịch HCl và H2SO4 loãng, một học sinh cho kết luận như sau:
Trong đó: dấu - không phản ứng, dấu + có phản ứng, dấu ↓↓ tạo kết tủa trắng.
Các kết luận sai là:
A.1, 2, 3. B.2, 3, 4.
C. 1, 2, 4. D. 1, 3, 4.
Câu 4: Để phân biệt 4 lọ mỗi lọ đựng một trong các dung dịch: HCl, NaCl, Na2SO4, H2SO4 người ta có thể sử dụng:
A.quỳ tím và dung dịch Ba(OH)2.
B. phenolphtalein và dung dịch BaCl2.
C. dung dịch Ba(OH)2.
D. sắt.
Câu 5: Trộn 600ml dung dịch NaCl 1M với 400ml dung dịch NaCl 2M.
Nồng độ của dung dịch NaCl thu được là:
A.1,5M B. 1,4M
C. 1,3M D. 1,6M.
Câu 6: Từ Cu, CuCO3 và dung dịch H2SO4 người ta có thể điều chế được khí nào trong các khí sau: H2, SO2, CO2, O2?
A. H2, SO2, CO2
B. H2, CO2, O2
C. H2, SO2, O2
D. SO2, CO2
Câu 7: Đơn chất nào sau đây khi tác dụng với dung dịch H2SO4 đặc, nung nóng sản phẩm phản ứng chỉ gồm một chất khí và hơi nước?
A.Cacbon. B. Nhôm.
C. Đồng. D. Lưu huỳnh.
Câu 8: Cho dãy khí sau: H2, SO2, CO2, O2, CO, NO. Khí không có khả năng làm đục nước vôi trong là:
A. SO2, CO2, O2, CO.
B. H2, SO2, CO2, O2
C. H2, O2, CO, NO
D. SO2, CO2, CO.
II. Tự luận (6 điểm)
Câu 9 (2 điểm): Cho các chất: SO2, CO2, CuO, MgO, Mg, H2O. Chọn chất thích hợp để điền vào chỗ trống trong các sơ đồ sau:
1. H2SO4 + Na2SO3 → Na2SO4 +....+....
2.......+........ → H2SO3
3. HCl +......→ MgCl2 + H2O
4........+ AgNO3 → Ag + Cu(NO3)2
Câu 10 (2 điểm): Nêu nhưng tính chất hóa học giống nhau và khác nhau của bazo tan và bazo không tan. Minh học bằng các phương trình hóa học.
Câu 11 (2 điểm): Xác định công thức phân tử của hợp chất có thành ohaanf khối lượng như sau: H = 3,7%, P = 37,8%, O = 58,5% (Cho H = 1, P = 31, O = 16).
------ HẾT ------
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
1. Đáp án
2. Lời giải
I. Trắc nghiệm (4 điểm mỗi câu 0,5 điểm)
Câu 1: (B)
Phương trình hóa học:
Fe + H2SO4 → FeSO4 + H2↑
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
2NaHCO3 + H2SO4 → Na2SO4 + 2CO2↑ + H2O
Na2SO3 + H2SO4 → Na2SO4 + SO2↑ + H2O
Câu 2: (D)
H2SO4 + BaCl2 → BaSO4↓ + 2HCl
BaSO3 + H2SO4 → BaSO4↓ + SO2↑ + H2O.
2NaHCO3 + H2SO4 → Na2SO4 + 2CO2↑ + H2O.
BaSO4 kết tủ trắng, khí bay ra tạo hiện tượng sủi bọt.
Câu 3: (A).1,2,3. Sai vì:
Cu không tác dụng với dung dịch H2SO4 loãng.
MgO tác dụng được với dung dịch H2SO4 loãng.
Na2CO3 tác dụng được với dung dịch HCl.
Câu 4: (A)
Quỳ tím và dung dịch BaCl2.
Các dung dịch làm quỳ tím hóa đỏ là: HCl, H2SO4.
Dùng baCl2 nhận ra H2SO4.
H2SO4 + BaCl2 → BaSO4↓ + 2HCl.
Các dung dịch không làm quỳ tím đổi màu là: NaCl, Na2SO4.
Dùng BaCl2 nhận ra được Na2SO4.
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl.
Câu 5: (B)
nNaCl = 0.6 + 0,8 = 1,4 mol.
⇒ Nồng độ mol/lít dung dịch NaCl = 1,4M.
Câu 6: (D)
Cu + 2H2SO4đặc → CuSO4 + SO2↑ + H2O
CuCO3 + 2H2SO4 → CuSO4 + CO2↑ + H2O.
Câu 7: (D)
S + 2H2SO4đặc → 3SO2↑ + 2H2O.
Câu 8: (C)
H2, O2, CO, NO. Chỉ có SO2, CO2 tác dụng với dung dịch Ca(OH)2 tạo ra chất không tan, nên làm nước vôi trong hóa đục.
SO2 + Ca(OH)2 → CaSO3 + H2O
CO2+Ca(OH)2→CaCO3↓+H2O.
II.Tự luận (6 điểm)
Câu 9:
Viết đúng mỗi phương trình 0,5 điểm.
1.H2SO4 + Na2SO4 → Na2SO4 + SO2 + H2O
2.SO2 + H2O H2SO3
3. HCl + MgO → MgCl2 + H2O
4.Cu + 2AgNO3 → 2Ag + Cu(NO3)2.
Câu 10:
Tính chất hóa học giống nhau và khác nhau của một bazo tan và bazo không tan, minh họa bằng các phương trình hóa học.
Giống nhau (1 điểm): cả 2 đều tác dụng được với dung dịch axit tạo muối và nước.
Ví dụ: NaOH + HCl→ NaCl + H2O
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
Khác nhau (1 điểm): Bazơ tan làm đổi màu các chất chỉ thị (quỳ tím, phenolphtalein), tác dụng với các dung dịch muối mà sản phẩm là chất không tan.
Ví dụ: 2NaOH + MgCl2 → Mg(OH)2↓ + 2NaCl.
2NaOH + MgCl2 → Mg(OH)2↓ + 2NaCl.
Câu 11:
Xác định công thức phân tử của hợp chất có thành phần khối lượng như sau: H = 3,7%, P = 37,8%, O = 58,5%.
Đặt công thức phân tử là HxPyOz
Ta có: x : y : z = 3,71 : 37,831 : 58,516 = 3 : 1 : 3
Vậy công thức phân tử là: H3PO3.
3. Đề thi giữa HK1 môn Hóa học 9 số 3
TRƯỜNG THCS NGUYỄN KHUYẾN
ĐỀ KIỂM TRA GIỮA HK1
MÔN: HÓA HỌC - LỚP 9
NĂM HỌC: 2019- 2020
I. Trắc nghiệm (4 điểm)
Câu 1: Người ta có thể phân biệt 2 dung dịch Ca(OH)2 và NAOH bằng cách dùng:
A. Khí CO2
B. Khí CO
C. quỳ tím
D. phenolphtalein.
Câu 2: Chỉ dùng các chất Na2CO3, NaCL, Ca(OH)2, Na, H2O để điều chế trực tiếp NaOH. Số phương trình hóa học (kể cả phương trình điện phân) sẽ là:
A.2 B.3
C.4 D.5.
Câu 3: Cho biết độ pH của một số dung dịch như sau:
Các dung dịch bazo là:
A.I, II. B.II, IV.
C. I, IV. D. II, III.
Câu 4: Để nhận ra 2 chất rắn, màu trắng là KOH, BaO đựng riêng trong 2 bình, người ta phải dùng:
A.Dung dịch phenolphtalein.
B.phương pháp nhiệt phân.
C. nước và CO2
D.quỳ tím ướt.
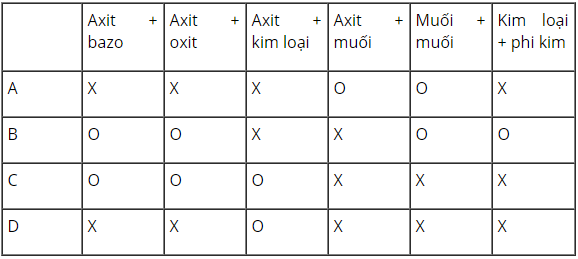
Câu 5: Để điều chế trực tiếp CuCl2 bằng phản ứng tổng quát nào sau đây là đúng (X: đúng, O: không đúng)?
Câu 6: Để chứng minh trong thành phần muối đồng (II) sunfat có nguyên tố đồng và góc sunfat người ta có thể dùng:
A.dung dịch NaOH
B.dung dịch BaCl2
C. kẽm và dung dịch BaCl2.
D. sắt.
Câu 7: Hãy chọn sơ đồ phản ứng thích hợp:
A .FeS2(+O2) → SO2(+O2) → SO3(+H2O) → H2SO4
B. FeS2(+O2) → SO2(+H2O) → H2SO4(+Ba(OH)2) →BaSO4
C. FeS2(+O2) → SO2(+O2,xt) →SO3(+H2O)→H2SO3
D. FeS2(+O2) → Fe2O3(+ddHCl) →FeCl3(+NaOH)→Fe(OH)2
Câu 8: Số chất khí tạo ra khi cho dung dịch H2SO4 loãng lần lượt tác dụng với các chất: NaHCO3, Na2CO3, Zn, Ba(OH)2, Na2SO3, Cu là:
A.2 B.3
C.5 D.2
II. Tự luận (6 điểm)
Câu 9 (2 điểm):Viết các phương trình hóa học điều chế H2 từ Zn, dung dịch H2SO4, dung dịch HCl.Nếu dùng H2SO4 và HCl cùng số mol thì lượng khí H2 sinh ra trong trường hợp naog nhiều hơn?
Câu 10 (2 điểm): Trên bàn thí nghiệm có những chất rắn màu trắng: NaHCO3, K2CO3, CaCO3. Hãy trình bày cách tìm ra NaHCO3.
Viết phương trình hóa học. Giải thích hiện tượng (nếu có).
Câu 11 (2 điểm): Cho 3,04 gam hỗn hợp NaOH và KOH tác dụng vừa đủ với dung dịch H2SO4, tạo ra 4,9 gam các muối sunfat. Tính khối lượng mỗi hidroxit trong hỗn hợp ban đầu. (Cho Na = 23, K = 39,5, S = 32, O = 16).
------ HẾT ------
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
1. Đáp án
I.Trắc nghiệm (4 điểm: mỗi câu 0,5 điểm)
Câu 1: (A)
Dung dịch Ca(OH)2 tạo kết tủa với CO2 còn dung dịch NaOH thì không.
CO2+Ca(OH)2→CaCO3↓+H2O.
Câu 2: (B)
Na2CO3 + Ca(OH)2 → CaCO3↓ + H2O
2Na + 2H2O → 2NaOH + H2↑
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
Câu 3: (C)
Các dung dịch bazo luôn có pH > 7.
Câu 4: (C)
BaO + H2O → Ba(OH)2
Ba(OH)2 + CO2 → BaCO3↓+H2O.
KOH tan trong nước nhưng tạo kết tủa với CO2.
Câu 5: (D)
Phương trình hóa học:
Axit + bazơ
Ví dụ: 2HCl + Cu(OH)2 → CuCl2 + 2H2O.
Axit + oxit.
Ví dụ: 2HCl + CuO → CuCl2 + H2O
Axit + muối.
Ví dụ: 2HCl + CuCO3 → CuCl2 + CO2↑ + H2O.
Muối + muối.
Ví dụ: BaCl2 + CuSO4 → CuCl2 + BaSO4↓
Kim loại + phi kim.
Ví dụ: Cl2 + Cu → CuCl2
Câu 6: (C)
Cho kẽm và dung dịch nếu thấy có Cu (màu đỏ) bám vào thanh kẽm là có thể kết luận dung dịch có muối đồng (II). Cũng cho BaCl2 vào dung dịch ban đầu đó, nếu có kết tủa trắng là có thể kết luận dung dịch có muối sunfat.
Phương trình hóa học:
Zn + CuSO4 → Cu + ZnSO4
BaCl2 + CuSO4 → CuCl2 + BaSO4↓
Câu 7: (A)
4FeS2 + 11O2 → 8SO2 + 2Fe2O3
2SO2 + O2 → 2SO3
SO3 + H2O → H2SO4
Câu 8: (B)
H2SO4 + 2NaHCO3 → Na2SO4 + CO2↑ + H2O
H2SO4 + Na2CO3 → Na2SO4 + CO2↑ + H2O
H2SO4 + Zn → ZnSO4 + H2↑
H2SO4 + Na2SO3 → Na2SO4 + SO2↑ + H2O
II.Tự luận (6 điểm)
Câu 9:
H2SO4 + Zn → ZnSO4 + H2↑
2HCl + Zn → ZnCl2 + H2↑
Theo hai phương trình thì dùng H2SO4 tạo ra khí H2 nhiều hơn dùng HCl.
Câu 10:
Hòa tan mẫu thử của từng chất vào nước. Chất không tan là CaCO3, dung dịch tạo ra cho tác dụng với CaCl2 chất không tạo kết tủa là NaHCO3, K2CO3 tạo ra dung dịch tác dụng với CaCl2 tạo kết tủa.
Phương trình hóa học: K2CO3 + CaCl2 → CaCO3 + 2KCl
Câu 11:
2NaOH + H2SO4 → Na2SO4 + 2H2O
2KOH + H2SO4 → K2SO4 + 2H2O
Gọi số mol của NaOH và KOH lần lượt là x và y, ta có:
40x+56y = 3,04 (1)
142.x/2+174.y/2 =4,9 (2)
Giải hệ phương trình (1) và (2) ta có:
x = 0,02 mol
y = 0,04 mol.
Vậy khối lượng NaOH = 0,02.40 = 0,8 gam.
Khối lượng của KOH = 0,04.56 = 2,24 gam.
4. Đề thi giữa HK1 môn Hóa học 9 số 4
TRƯỜNG THCS LÊ QUÝ ĐÔN
ĐỀ KIỂM TRA GIỮA HK1
MÔN: HÓA HỌC - LỚP 9
NĂM HỌC: 2019- 2020
Câu 1: Có ống nghiệm đựng các dung dịch: CuSO4, FeSO4, K2CO3. Lần lượt cho dung dịch NaOH vào mỗi ống nghiệm. Dung dịch NaOH phản ứng với:
A.CuSO4, FeSO4.
B.CuSO4
C. FeSO4
D. CuSO4, FeSO4, K2CO3
Câu 2: Cho 0,2 mol khí SO2 vào dung dịch có chứa 0,3 mol KOH, sau khi phản ứng kết thúc dung dịch có:
A. KHSO3 B. K2SO3
C. KHSO3 và K2SO3 D. K2SO4
Câu 3: Cho 5,6 gam sắt vào dung dịch HCl (dư) thể tích khí H2 thoát ra (đktc) là (Fe = 56):
A.5,6 lít B.3,36 lít
C.4,48 lít D. 2,24 lít.
-----Còn tiếp-----
5. Đề thi giữa HK1 môn Hóa học 9 số 5
TRƯỜNG THCS NGUYỄN TRÃI
ĐỀ KIỂM TRA GIỮA HK1
MÔN: HÓA HỌC - LỚP 9
NĂM HỌC: 2019- 2020
I. TRẮC NGHIỆM (4 điểm)
Câu 1: Có các chất sau: Na2O, Fe2O3, CaO, SO2, CO2, H2O. Những chất có thể điều chế bằng phản ứng hóa hợp là
A. CaO, Fe2O3, SO2, CO2, H2O
B. Fe2O3, CaO, SO2, CO2, H2O, Na2O
C. Na2O, Fe2O3, CO2, SO2, H2O
D. Na2O, CaO, CO2, H2O, Fe2O3
Câu 2: Khí CO có lẫn khí SO2 và khí CO2. Có thể loại SO2, CO2 bằng cách cho hỗn hợp qua
A. lượng dư dung dịch Ca(OH)2
B. dung dịch NaOH
C. H2O
D. CuO nung mạnh
Câu 3: Trong phòng thí nghiệm K2O rất khó bảo quản, vì K2O
A. rất dễ tác dụng với hơi nước và khí CO2 trong không khí
B. kém bền dễ bị ánh sang phân hủy
C. rất dễ tác dụng với khí O2 trong không khí
D. kém bền dễ bị phân hủy bởi nhiệt
-----Còn tiếp-----
6. Đề thi giữa HK1 môn Hóa học 9 số 6
TRƯỜNG THCS NGUYỄN DU
ĐỀ KIỂM TRA GIỮA HK1
MÔN: HÓA HỌC - LỚP 9
NĂM HỌC: 2019- 2020
Câu 1: Hiện tượng quan sát được khi cho một ít Na vào nước là
A. mẩu Na vo tròn chạy quanh trên bề mặt dung dịch và tan dần
B. dung dịch có màu xanh
C. mẩu Na chìm trong dung dịch
D. không có khí thoát ra
Câu 2: Để nhận biết các dung dịch: BaCl2, KNO3, Na2SO4, FeSO4 đựng trong các bình riêng rẽ, người ta có thể dùng
A. dung dịch NaCl
B. dung dịch NaOH
C. quỳ tím
D. Sn
Câu 3: Phản ứng của Cu với dung dịch AgNO3 tạo ra Ag và Cu(NO3)2 được gọi là phản ứng
A. cộng B. hóa hợp C. thay thế D. trao đổi
---Bấm TẢI VỀ hoặc XEM ONLINE để xem đầy đủ nội dung các đề số 4- 6---
7. Đề thi giữa HK1 môn Hóa 9 số 7
Trường THCS Phan Chu Trinh
Số câu: 8 câu trắc nghiệm, 3 câu tự luận
Thời gian làm bài: 45 phút
Năm học: 2019- 2020
-----Còn tiếp-----
8. Đề thi giữa HK1 môn Hóa 9 số 8
Trường THCS Nguyễn Văn Nghi
Số câu: 8 câu trắc nghiệm, 3 câu tự luận
Thời gian làm bài: 45 phút
Năm học: 2019- 2020
-----Còn tiếp-----
9. Đề thi giữa HK1 môn Hóa 9 số 9
Trường THCS Lê Văn Tám
Số câu: 8 câu trắc nghiệm, 3 câu tự luận
Thời gian làm bài: 45 phút
Năm học: 2019- 2020
-----Còn tiếp-----
10. Đề thi giữa HK1 môn Hóa 9 số 10
Trường THCS Võ Thị Sáu
Số câu: 8 câu trắc nghiệm, 3 câu tự luận
Thời gian làm bài: 45 phút
Năm học: 2019- 2020
---Bấm TẢI VỀ hoặc XEM ONLINE để xem đầy đủ nội dung các đề số 7-10---



.PNG)