Giải bài tập SGK Hóa 8 Bài 22: Tính theo phương trình hóa học
Hướng dẫn Giải bài tập Hóa học 8 Bài 22 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về tính theo phương trình hóa học. Mời các em cùng theo dõi.
Mục lục nội dung

1. Giải bài 1 trang 75 SGK Hóa học 8
Sắt tác dụng với axit clohiđric:
Fe + 2HCl → FeCl2 + H2
Nếu có 2,8 g sắt tham gia phản ứng, em hãy tìm:
a) Thể tích khí hiđro thu được ở đktc.
b) Khối lượng axit clohiđric cần dùng.
Phương pháp giải
Các bước tiến hành:
- Bước 1. Viết phương trình hóa học.
- Bước 2. Chuyển đổi khối lượng chất thành số mol chất.
- Bước 3. Dựa vào phương trình hóa học để tìm số mol chất tham gia hoặc chất tạo thành.
- Bước 4. Chuyển đổi số mol chất thành khối lượng hoặc thể tích khí ở đktc.
Hướng dẫn giải
Câu a
Số mol sắt tham gia phản ứng:
\({n_{Fe}} = \frac{m}{M} = \frac{{2,8}}{{56}} = 0,05(mol)\)
Phương trình hóa học:
Fe + 2HCl → FeCl2 + H2
Theo phương trình hóa học, ta có: nH2 = nFe = 0,05 mol
Thể tích khí thu được ở đktc là: VH2 = 22,4 . n = 22,4 . 0,05 = 1,12 lít.
Câu b
Theo phương trình hóa học, ta có:
nHCl = 2nFe = 2 . 0,05 = 0,1 mol
Khối lượng HCl cần dùng là: mHCl = M . n = 0,1 . 36,5 = 3,65 gam.
2. Giải bài 2 trang 75 SGK Hóa học 8
Lưu huỳnh S cháy trong không khí sinh ra chất khí mùi hắc, gây ho, đó là khí lưu huỳnh đioxit có công thức hóa học là SO2
a) Viết phương trình hóa học của phản ứng lưu huỳnh cháy trong không khí.
b) Biết khối lượng lưu huỳnh đioxit tham gia phản ứng là 1,6 g. Hãy tìm:
- Thể tích khí lưu huỳnh đioxit sinh ra ở đktc.
- Thể tích không khí cần dùng ở đktc. Biết khí oxi chiếm 1/5 thể tích của không khí.
Phương pháp giải
Các bước tiến hành:
- Viết phương trình hóa học.
- Chuyển đổi khối lượng chất hoặc thể tích chất khí thành số mol chất
- Dựa vào phương trình hóa học để tìm số mol chất tham gia hoặc chất tạo thành
- Chuyển đổi số mol chất thành khối lượng (m = n . M) hoặc thể tích khí ở đktc (V = 22,4 . n)
Hướng dẫn giải
Câu a
Phương trình hóa học của S cháy trong không khí:
S + O2 \(\xrightarrow{{{t^o}}}\) SO2
Câu b
Số mol của lưu huỳnh tham gia phản ứng:
nS = 16 / 32 = 0,05 mol
Theo phương trình hóa học, ta có: nSO2 = nS = nO2 = 0,05 mol
Thể tích khí sunfurơ sinh ra ở đktc là:
VSO2 = 22,4 . n = 22,4 . 0,05 = 1,12 lít.
Tương tự thể tích khí oxi cần dùng ở đktc là:
VO2 = 22,4 . n = 22,4 . 0,05 = 1,12 lít.
Vì khí oxi chiếm 1/5 thể tích của không khí nên thể tích không khí cần là:
⇒ Vkk = 5 . VO2 = 5 . 1,12 = 5,6 lít.
3. Giải bài 3 trang 75 SGK Hóa học 8
Có phương trình hóa học sau:
CaCO3 \(\xrightarrow{{{t^o}}}\) CaO + CO2
a) Cần dùng bao nhiêu mol CaCO3 để điều chế được 11,2 g CaO?
b) Muốn điều chế được 7 g CaO cần dùng bao nhiêu gam CaCO3?
c) Nếu có 3,5 mol CaCO3 tham gia phản ứng sẽ sinh ra bao nhiêu lít CO2 (đktc)?
d) Nếu thu được 13,44 lít khí CO2 ở đktc thì có bao nhiêu gam chất rắn tham gia và tạo thành sau phản ứng?
Phương pháp giải
Các bước tiến hành:
- Viết phương trình hóa học.
- Chuyển đổi khối lượng chất hoặc thể tích chất khí thành số mol chất
- Dựa vào phương trình hóa học để tìm số mol chất tham gia hoặc chất tạo thành
- Chuyển đổi số mol chất thành khối lượng (m = n . M) hoặc thể tích khí ở đktc (V = 22,4 . n)
Hướng dẫn giải
Câu a
Phương trình phản ứng hóa học:
CaCO3 \(\xrightarrow{{{t^o}}}\) CaO + CO2
Theo phương trình phản ứng hóa học, ta có:
nCaCO3 = nCaO = 11,2 / 56 = 0,2 mol.
Câu b
Số mol: nCaCO3 = nCaO = 7 / 56 = 0,125 mol
Khối lượng CaCO3 cần thiết là:
mCaCO3 = M . n = 100 . 0,125 = 12,5 gam.
Câu c
Theo phương trình hóa học, ta có:
nCaCO3 = nCaO = 3,5 mol.
VCO2 = 22,4 . n = 22,4 . 3,5 = 78,4 lít.
Câu d
nCaCO3 = nCaO = nCO2 = 13,44 / 22,4 = 0,6 mol.
mCaCO3 = 0,6 . 100 = 60 g.
mCaO = 0,6 . 56 = 33,6 g.
4. Giải bài 4 trang 75 SGK Hóa học 8
a) Cacbon oxit CO tác dụng với khí oxi tạo ra cacbon đioxit. Hãy viết phương trình hóa học?
b) Nếu muốn đốt cháy 20 ml CO thì phải dùng bao nhiêu mol O2 để sau phản ứng người ta chỉ thu được một chất khí duy nhất?
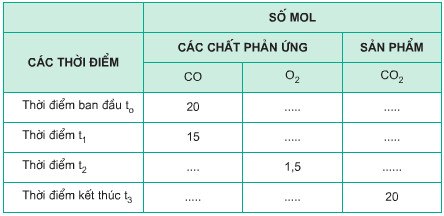
c) Hãy điền vào những ô trống số mol các chất phản ứng và sản phẩm có ở những thời điểm khác nhau. Biết hỗn hợp CO và O2 ban đầu được lấy đúng tỉ lệ về số mol các chất theo phương trình hóa học?
Phương pháp giải
Các bước tiến hành:
- Viết phương trình hóa học.
- Chuyển đổi khối lượng chất hoặc thể tích chất khí thành số mol chất
- Dựa vào phương trình hóa học để tìm số mol chất tham gia hoặc chất tạo thành
Hướng dẫn giải
Câu a
Phương trình hóa học của phản ứng:
2CO + O2 \(\xrightarrow{{{t^o}}}\) 2CO2
Câu b
Để thu được một chất khí duy nhất là CO2 thì số mol oxi cần dùng là:
\({n_{{O_2}}} = {1 \over 2}{n_{C{O_2}}} = 1.{{20} \over 2} = 10mol\)
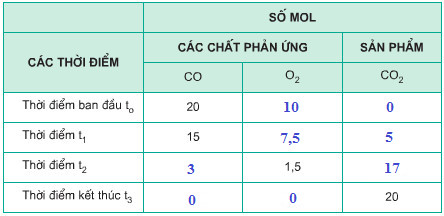
Câu c
Bảng số liệu trên được hoàn thành như sau:
5. Giải bài 5 trang 76 SGK Hóa học 8
Hãy tìm thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A.
Biết rằng:
- Khí A có tỉ lệ khối đối với không khí là 0,552.
- Thành phần theo khối lượng của khí A là: 75% C và 25% H.
Các thể tích khí đo ở đktc.
Phương pháp giải
Các bước tiến hành:
- Tính khối lượng mol của A dựa vào tỉ khối.
- Tính khối lượng C, H.
- Đặt công thức hóa học của khí A là CxHy:
12.x = mC ⇒ x = ?.
1.y = mH ⇒ y = ?.
- Dựa vào phương trình hóa học để tìm số mol chất tham gia hoặc chất tạo thành.
Hướng dẫn giải
Ta có:
dA/kk = 0,552 ⇒ MA = 29.0,552 = 16 g/mol
\({m_C} = \frac{{16.75}}{{100}} = 12\) g.
\({m_H} = \frac{{16.25}}{{100}} = 4\) g.
Đặt công thức hóa học của khí A là CxHy, ta có:
12.x = 12 ⇒ x = 1.
1.y = 4 ⇒ y = 4.
Công thức hóa học của khí A là CH4.
Phương trình hóa học đốt cháy khí CH4:
CH4 + 2O2 \(\xrightarrow{{{t^o}}}\) CO2 + 2H2O
Tỉ lệ thể tích cũng là tỉ lệ số mol nên thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A là:
VO2 = 2.VCH4 = 11,2 . 2 = 22,4 lít.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 8 Bài 18: Mol
- doc Giải bài tập SGK Hóa 8 Bài 19: Chuyển đổi giữa khối lượng, thể tích và lượng chất
- doc Giải bài tập SGK Hóa 8 Bài 20: Tỉ khối của chất khí
- doc Giải bài tập SGK Hóa 8 Bài 21: Tính theo công thức hóa học
- doc Giải bài tập SGK Hóa 8 Bài 23: Bài luyện tập 4



