Giải bài tập SGK Hóa 8 Bài 34: Bài luyện tập 6
Hướng dẫn Giải bài tập Hóa học 8 Bài 34 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về hidro. Mời các em cùng theo dõi.
Mục lục nội dung

1. Giải bài 1 trang 118 SGK Hóa học 8
Viết phương trình hóa học biểu diễn phản ứng của hiđro với các chất: O2, Fe2O3, Fe3O4, PbO ở nhiệt độ thích hợp. Ghi rõ điều kiện phản ứng. Giải thích và cho biết mỗi phản ứng trên thuộc loại phản ứng gì?
Phương pháp giải
- Viết phương trình hóa học xảy ra
- Phân loại các phương trình hóa học thành các dạng:
+ Phản ứng hóa hợp: từ hai hay nhiều chất ban đầu tạo ra 1 sản phẩm
+ Phản ứng phân hủy: Từ 1 chất ban đầu tạo thành 2 hay nhiều chất sản phẩm
+ Phản ứng oxi hóa khử: là phản ứng hóa học đồng thời xảy ra sự oxi hóa và sự khử
+ Phản ứng thế: là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
Hướng dẫn giải
Phương trình hóa học biểu diễn các phản ứng:
\(2{H_2} + {O_2}\xrightarrow{{{t^o}}}2{H_2}O\) (Phản ứng hóa hợp + oxi hóa - khử)
\({F{e_2}{O_3} + 3{H_2}\xrightarrow{{{t^o}}}2Fe + 3C{O_2}}\) (Phản ứng thế + oxi hóa - khử)
\({F{e_3}{O_4} + 4{H_2}\xrightarrow{{{t^o}}}3Fe + 4{H_2}O}\) (Phản ứng thế + oxi hóa - khử)
\({PbO + {H_2}\xrightarrow{{{t^o}}}Pb + {H_2}O}\) (Phản ứng thế + oxi hóa - khử)
Các phản ứng trên đều là phản ứng oxi – hóa khử vì đều có đồng thời sự khử và sự oxi hóa.
2. Giải bài 2 trang 118 SGK Hóa học 8
Có 3 lọ đựng riêng biệt các chất khí sau: khí oxi, không khí, và hiđro. Bằng thí nghiệm nào có thể nhận ra chất khí trong mỗi lọ?
Phương pháp giải
Dựa vào tính chất hóa học khác nhau của 3 khí để chọn thuốc thử phân biệt được chúng.
Hướng dẫn giải
Cách nhận biết 3 lọ khí khí oxi, không khí và hiđro:
Dùng một que đóm đang cháy cho vào mỗi lọ:
- Lọ cho que đóm sáng bùng lên: lọ chứa oxi.
- Lọ không làm thay đổi ngọn lửa: lọ chứa không khí.
- Lọ làm que đóm cháy với ngọn lửa màu xanh mờ và có tiếng nổ lách tách nhẹ là lọ chứa hiđro.
3. Giải bài 3 trang 119 SGK Hóa học 8
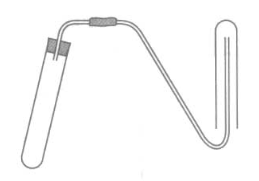
Cho dung dịch axit sunfuric loãng, nhôm và các dụng cụ thí nghiệm như hình vẽ.
Hãy chọn câu trả lời đúng trong các câu sau:
A. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu khí oxi.
B. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu không khí.
C. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu khí hiđro.
D. Có thể dùng để điều chế hiđro nhưng không thu được khí hiđro.
Phương pháp giải
Để chọn đáp án đúng cần nắm rõ sản phẩm của phản ứng giữa axit sunfuric loãng, nhôm.
Hướng dẫn giải
Cho dung dịch axit sunfuric loãng, nhôm và các dụng cụ thí nghiệm như hình vẽ có thể điều chế và thu khí hiđro. Vì khí H2 nhẹ hơn không khí nên úp ngược ống nghiệm sẽ thu được khí H2.
⇒ Đáp án C.
4. Giải bài 4 trang 119 SGK Hóa học 8
a) Lập phương trình hóa học của các phản ứng sau:
Cacbon đioxit + nước → Axit cacbonic (H2CO3).
Lưu huỳnh đioxit + nước → Axit sunfurơ (H2SO3).
Kẽm + axit clohiđric → Kẽm clorua + H2.
Điphotpho pentaoxit + nước → Axit photphoric (H3PO4).
Đồng (II) oxit + hiđro → Chì (Pb) + H2O.
b) Mỗi phản ứng hóa học trên đây thuộc loại phản ứng nào? Vì sao?
Phương pháp giải
- Từ tên gọi của các chất => dịch đúng ra công thức hóa học
- Cân bằng phương trình hóa học
- Phân loại các phản ứng thuộc: phản ứng hóa hợp, phản ứng phân hủy, phản ứng oxi hóa khử, phản ứng thế.
Hướng dẫn giải
Câu a
Phương trình hóa học được hoàn thành như sau:
CO2 + H2O → H2CO3 (1)
SO2 + H2O → H2SO3 (2)
Zn + 2HCl → ZnCl2 + H2O (3)
P2O5 + 3H2O → 2H3PO4 (4)
CuO + H2 → Cu + H2O (5)
Câu b
- Phản ứng (1), (2) và (4) là phản ứng hóa hợp vì một chất mới tạo thành từ nhiều chất.
- Phản ứng (3) và (5) là phản ứng thế vì có sự chiếm oxi và nhường oxi.
- Phản ứng (5) là phản ứng oxi hóa khử vì có xảy ra đồng thời sự oxi hóa và sự khử.
5. Giải bài 5 trang 119 SGK Hóa học 8
a) Hãy viết phương trình hóa học của các phản ứng giữa hiđro với hỗn hợp đồng (II) oxit và sắt (III) oxit ở nhiệt độ thích hợp?
b) Trong các phản ứng hóa học trên, chất nào là chất khử, chất nào là chất oxi hóa? Vì sao?
c) Nếu thu được 6,00 gam hỗn hợp hai kim loại, trong đó có 2,8 g sắt thì thể tích (ở đktc) khí hiđro vừa đủ cần dùng để khử đồng (II) oxit và sắt (III) oxit là bao nhiêu?
Phương pháp giải
a. Hiđro + oxit → kim loại + nước
b. Chất khử: chất chiếm oxi
Chất oxi hóa: chất nhường oxi
c. Tính số mol Fe : nFe = 2,8/56=?(mol)
Tính khối lượng Cu: mCu = mhh – mFe = ? (g)
=> nCu=mCu / 64=?(mol)
Dựa vào phương trình hóa học đã viết ở phần a, tính toán số mol H2 theo số mol của Fe và Cu
Hướng dẫn giải
Câu a
Phương trình hóa học của các phản ứng giữa hiđro với hỗn hợp đồng (II) oxit và sắt (III) oxit:
H2 + CuO \(\xrightarrow{{{t^o}}}\) Cu + H2O (1)
3H2 + Fe2O3 \(\xrightarrow{{{t^o}}}\) 2Fe + 3H2O (2)
Câu b
Trong 2 phản ứng trên:
- Chất khử là H2 vì chiếm oxi của chất khác
- Chất oxi hóa là CuO và Fe2O3 vì nhường oxi cho chất khác.
Câu c
Lượng đồng có trong 6g hỗn hợp 2 kim loại thu được:
mCu = 6 - 2,8 = 3,2 g.
Số mol đồng và sắt là:
nCu = 3,2 / 64 = 0,05 mol.
nFe = 2,8 / 56 = 0,05 mol.
nH2(1) = nCu = 0,05 mol.
Thể tích khí hiđro cần dùng để khử đồng (II) oxit là:
VH2(1) = 0,05. 22,4 = 1,12 lít.
nH2(2) = 3/2 . nFe = 3/2 . 0,05 = 0,075 mol.
VH2(2) = 0,075 . 22,4 = 1,68 lít.
6. Giải bài 6 trang 119 SGK Hóa học 8
Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a) Viết các phương trình hóa học của phản ứng.
b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit sunfuric? Kim loại nào cho nhiều khi hiđro nhất?
c) Nếu thu được cùng một thể tích khí hiđro thì khối lượng kim loại nào nhỏ nhất?
Phương pháp giải
a. Kim loại + axit → muối + khí hidro
b. Giả sử cùng một lượng mỗi kim loại là a (gam) => tính số mol của mỗi kim loại
=> Dựa vào phương trình hóa học xem số mol H2 sinh ra ở phương trình nào nhiều nhất thì kim loại đó cho nhiều khí nhất.
c. Giả sử cùng thu được 1 thể tích khí H2 là 22,4 lít => số mol H2
Dựa vào phương trình hóa học tính số mol và khối lượng các kim loại =>khối lượng kim loại nào nhỏ nhất
Hướng dẫn giải
Câu a
Phương trình hóa học của phản ứng:
Zn + H2SO4 → ZnSO4 + H2
Fe + H2SO4 loãng → FeSO4 + H2
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2
Câu b
Giả sử cho cùng một khối lượng là a g kim loại kẽm sắt và nhôm
Ta có:
\(\\ n_{Fe} = \frac{a}{56} \\ \\ n_{Zn} = \frac{a}{65} \\ \\ n_{Al} = \frac{a}{27}\)
Ta nhận thấy: \(\frac{3a}{54 } > \frac{a}{56} > \frac{a}{65}\)
Như vậy cho cùng một lượng kim loại tác dụng với axit H2SO4 loãng dư thì nhôm cho nhiều khí hidro hơn, sau đó đến sắt.
Câu c
Nếu thu được cùng một lượng khí hidro thì khối lượng kim loại ít nhất là nhôm, sau đó đến sắt, cuối cùng là kẽm.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 8 Bài 31: Tính chất- Ứng dụng của hiđro
- doc Giải bài tập SGK Hóa 8 Bài 32: Phản ứng oxi hóa- khử
- doc Giải bài tập SGK Hóa 8 Bài 33: Điều chế hidro- Phản ứng thế
- doc Giải bài tập SGK Hóa 8 Bài 36: Nước
- doc Giải bài tập SGK Hóa 8 Bài 37: Axit- bazơ- muối
- doc Giải bài tập SGK Hóa 8 Bài 38: Bài luyện tập 7