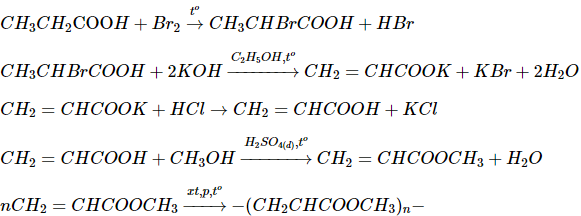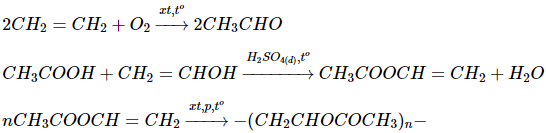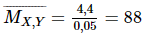Giải bài tập SBT Hóa 12 Bài 4: Luyện tập: Este và chất béo
Hướng dẫn Giải bài tập Sách bài tập Hóa học 12 Bài 4 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về tính chất của este và chất béo. Mời các em cùng theo dõi.
Mục lục nội dung
1. Giải bài 4.1 trang 8 SBT Hóa học 12
2. Giải bài 4.2 trang 8 SBT Hóa học 12
3. Giải bài 4.3 trang 8 SBT Hóa học 12
4. Giải bài 4.4 trang 9 SBT Hóa học 12
5. Giải bài 4.5 trang 9 SBT Hóa học 12
6. Giải bài 4.6 trang 9 SBT Hóa học 12
7. Giải bài 4.7 trang 10 SBT Hóa học 12

1. Giải bài 4.1 trang 8 SBT Hóa học 12
Cho các phát biểu sau :
a) Chất béo thuộc loại hợp chất este.
b) Các este không tan trong nước do chúng nhẹ hơn nước.
c) Các este không tan trong nước và nổi trên mặt nước do chúng không tạo được liên kết hiđro với nước và nhẹ hơn nước.
d) Khi đun chất béo lỏng trong nồi hấp rồi sục dòng khí hiđro vào (có xúc tác niken) thì chúng chuyển thành chất béo rắn
e) Chất béo lỏng là các triglixerit chứa gốc axit không no trong phân tử.
Những phát biểu đúng là
A. a, d, e. B. a, b, d.
C. a, c, d, e. D. a, b, c, d, e.
Phương pháp giải
Dựa vào lý thuyết chất béo và este để trả lời câu hỏi trên.
Hướng dẫn giải
a) Đúng, chất béo là trieste của các axit béo với glixerol nên chất béo thuộc loại hợp chất este.
b) Sai, este không tan trong nước do khả năng tạo liên kết hiđro với các phân tử nước rất kém.
c) Đúng.
d) Đúng, các chất béo lỏng chứa gốc axit béo không no. Khi tham gia phản ứng hiđro hóa trở thành các gốc axit béo no. Các chất béo rắn chứa gốc axit béo no.
e) Đúng
→ Chọn C.
2. Giải bài 4.2 trang 8 SBT Hóa học 12
Khi cho một ít mỡ lợn (sau khi rán, giả sử là tristearin) vào bát sứ đựng dung dịch NaOH, sau đó đun nóng và khuấy đều hỗn hợp một thời gian. Khi đó quan sát được hiện tượng nào sau đây ?
A. Miếng mỡ nổi ; sau đó tan dần.
B. Miếng mỡ nổi ; không thay đổi gì trong quá trình đun nóng và khuấy
C. Miếng mỡ chìm xuống ; sau đó tan dần.
D. Miếng mỡ chìm xuống ; không tan.
Phương pháp giải
Dựa vào lý thuyết chất béo và este để xác định hiện tượng xảy ra khi cho một ít mỡ lợn (sau khi rán, giả sử là tristearin) vào bát sứ đựng dung dịch NaOH, sau đó đun nóng và khuấy đều hỗn hợp một thời gian.
Hướng dẫn giải
Chất béo nhẹ hơn nước và không tan trong nước nên miếng mỡ nổi lên trên.
Mỡ lợn chứa tristearin nên có phản ứng thủy phân của tristearin trong môi trường bazơ
H35COO)3C3H5 + 3NaOH → 3C17H35COONa + C3H5(OH)3
Nên miếng mỡ tan dần
→ Chọn A.
3. Giải bài 4.3 trang 9 SBT Hóa học 12
Xà phòng hoá 4,4 g este X có CTPT C4H802 trong dung dịch NaOH thu được 4,1 g muối của axit Y. Công thức cấu tạo của X là
a. HCOOC3H7
b. CH3COOC2H5
c. C2H5COOCH3
d. HCOOCH2CH2CH3
Phương pháp giải
nRCOONa = nRCOOR’
MRCOONa
Công thức của muối
Công thức của X
Hướng dẫn giải
= 4,4/88 = 0,05mol
Gọi công thức tổng quát của X là RCOOR’
PTHH:
OOR′ + NaOH → RCOONa + R'OH
Theo phương trình, ta có: nRCOONa = nRCOOR’ = 0,05 mol
Na = 4,1/0,05 = 82
muối: CH3COONa
Mà CTPT của X là C4H8O2
X: CH3COOC2H5
→ Chọn B.
4. Giải bài 4.4 trang 9 SBT Hóa học 12
Đun 6,6 g hỗn hợp gồm 2 este X, Y đồng phân có CTPT C4H8O2 trong dung dịch NaOH vừa đủ thu được 6,5 g hỗn hợp 2 muối của 2 axit đồng đẳng kế tiếp nhau. Hai este có công thức là
A. HCOOC3H7 và CH3COOC2H5
B. CH3COOC2H5 và C2H5COOCH3
C. CH3COOC2H3 và CH3COOC3H7
D. CH3COOCH3 và C2H5COOCH3
Phương pháp giải
nRCOONa = nRCOOR’
Na
Công thức của 2 muối
Công thức của 2 este
Hướng dẫn giải
=6,6/88 = 0,075 mol
Gọi công thức tổng quát của 2 este X, Y là RCOOR’
PTHH:
OOR′+NaOH→RCOONa + R'OH
Theo phương trình, ta có: nRCOONa = nRCOOR’ = 0,075 mol
Na = 6,5/0,075 = 86,67
2 muối có công thức là CH3COONa và C2H5COONa.
Mà este X, Y đều có công thức phân tử là C4H8O2
2 este có công thức là CH3COOC2H5 và C2H5COOCH3
→ Chọn B.
5. Giải bài 4.5 trang 9 SBT Hóa học 12
Giải thích tại sao khi cho isoamyl axetat (dầu chuối) vào cốc đựng dung dịch natri hiđroxit thấy chất lỏng trong cốc tách thành hai lớp, nhưng khi khuấy đều và đun sôi hỗn hợp một thời gian thấy chất lỏng trong cốc tạo thành một dung dịch đồng nhất?
Phương pháp giải
Cần nắm rõ lý thuyết về este để giải thích vì sao xảy ra hiện tượng trên.
Hướng dẫn giải
Dầu chuối không tan trong nước vì nó không có khả năng tạo được liên kết hiđro với nước và vì khối lượng riêng nhỏ hơn nước nên dầu chuối nổi trên mặt nước (hoặc dung dịch kiềm).
Khi đun sôi và khuấy đều đã xảy ra phản ứng xà phòng hoá este :
CH3COOCH2CH2CH(CH3)2 + NaOH→ CH3COONa + OHCH2CH2CH(CH3)2
Sản phẩm phản ứng tan được trong nước (hoặc dung dịch kiềm dư) nên tạo thành dung dịch đồng nhất.
6. Giải bài 4.6 trang 9 SBT Hóa học 12
Viết các phương trình hóa học để hoàn thành các dãy biến hóa sau:
\(a.{C_2}{H_4} \to C{H_3}CHO\xrightarrow{{B{r_2},{H_2}O}}A\xrightarrow{{ + B}}{C_4}{H_8}{O_2}\xrightarrow{{LiAl{H_4},{t^o}}}B\)
\(b.C{H_3}C{H_2}{\text{COO}}H \to C{H_3}CHBrCOOH \to C{H_2} = CHCOOK\)
\( \to C{H_2} = CHCOOH \to C{H_2} = CHCOOC{H_3} \to po\lim e\)
\(c.C{H_2} = C{H_2} \to C{H_3}CHO \to C{H_3}{\text{COO}}H\)
\( \to C{H_3}{\text{COOCH = C}}{{\text{H}}_2} \to po\lim e\,1 \to po\lim e\,2\)
Phương pháp giải
Dựa vào tính chất hóa học, phương trình điều chế của các hợp chất hữu cơ.
Hướng dẫn giải
a)
\(C{H_2} = C{H_2} + 1/2{O_2} \to C{H_3}CHO\)
\(C{H_3}CHO + B{r_2} + {H_2}O \to C{H_3}{\text{COO}}H + 2HBr\)
\(C{H_3}{\text{COO}}H + {C_2}{H_5}OH\overset {{H_2}S{O_4},{t^o}} \leftrightarrows C{H_3}{\text{COO}}{C_2}{H_5} + {H_2}O\)
\(C{H_3}{\text{COO}}H + {C_2}{H_5}OH \to C{H_3}{\text{COO}}{C_2}{H_5} + {H_2}O\)
\(C{H_3}{\text{COO}}{C_2}{H_5}\xrightarrow{{{t^o}}}2{C_2}{H_5}OH\)
b)
c)
7. Giải bài 4.7 trang 10 SBT Hóa học 12
Để xà phòng hoá hoàn toàn 19,4 g hỗn hợp hai este đơn chức A và B cần 200 ml dung dịch natri hiđroxit 1,5M. Sau khi phản ứng hoàn toàn, cô cạn dung dịch, thu được hỗn hợp hai ancol đồng đẳng kế tiếp nhau và một muối khan X duy nhất. Tìm công thức cấu tạo, gọi tên và tính phần trăm khối lượng của mỗi este có trong hỗn hợp ban đầu.
Phương pháp giải
- Tính được M tb hai este
- Tìm CTPT hai ancol=> CTPT hai este
- Lập hệ phương trình tính số mol hai este
- Tinh % theo khối lượng mỗi este.
Hướng dẫn giải
n NaOH= 1,5.0,2=0,3 mol
Hai este có cùng gốc axit vì cùng tạo ra một muối sau khi xà phòng hoá. Đặt công thức của 2 este là OOR1 và OOR2
Đặt công thức chung của 2 este là RCOOR’
RCOOR’ + NaOH → RCOONa + R’OH
Theo phương trình hoá học : n NaOH = n RCOOR’ = 0,3 mol
→ M RCOOR’==64,67
→ MR + MR’ = 64,67 – 44= 20,67
Vậy hai ancol phải là CH3OH và C2H5OH, còn axit là HCOOH.
Công thức cấu tạo của 2 este là :
HCOOCH3 (metyl fomat) và HCOOCH2CH3 (etyl fomat).
Gọi số mol của HCOOCH3 và HCOOCH2CH3 trong hỗn hợp là x và y.
Ta có hệ pt:
n hh este = x+ y = 0,3
m hh este = 60x + 74y = 19,4
→ x= 0,2 ; y= 0,1
%m HCOOCH3 = (19,4.100% = 61,86%
%m HCOOCH2CH3= 100- 61,86= 38,14%
8. Giải bài 4.8 trang 10 SBT Hóa học 12
Cho ancol A tác dụng với axit B thu được este X. Làm bay hơi 8,6 g este X thu được thể tích hơi bằng thể tích của 3,2 g khí oxi (đo ở cùng điều kiện nhiệt độ và áp suất). Tìm công thức cấu tạo và tên gọi của A, B, X, biết A có phân tử khối lớn hơn B.
Phương pháp giải
- Tính Meste
=> MR + MR1
- Lập bảng tìm R và R1
Hướng dẫn giải
Vì nO2 =0,10 mol nên MX = 86 g/mol.
Vây X là este đơn chức RCOOR1 với MR + M R1 = 42. Các cặp giá trị có thể có:
X tạo ra từ ancol và axit nên X có công thức cấu tạo :
HCOOCH2CH=CH2 (I) hoặc CH2=CHCOOCH3 (II).
Vì A có phân tử khối lớn hơn B nên X có công thức cấu tạo (I).
→ A là CH2=CH-CH2OH (ancol anlylic)
B là HCOOH (axit fomic)
X là HCOOCH2CH=CH2 ( anlyl fomat).
9. Giải bài 4.9 trang 10 SBT Hóa học 12
Cho hỗn hợp 2 este X, Y đồng phân cấu tạo của nhau. Hóa hơi 4,4 g hỗn hợp thu được thể tích hơi bằng thể tích của 1,6 g khí oxi (ở cùng điều kiện). Xà phòng hóa hoàn toàn 4,4 g hỗn hợp trên trong 100 g dung dịch NaOH 4% sau đó cô cạn dung dịch sau phản ứng thu được 5,75 g chất rắn và hỗn hợp 2 ancol đồng đẳng kế tiếp nhau. Xác định X, Y và % khối lượng của chúng trong hỗn hợp.
Phương pháp giải
- Từ công thức m / n suy ra M của hai este X, Y
- Tính khối lượng NaOH dư, dựa vào tỷ lệ phản ứng giữa este và NaOH
- Từ đó suy ra khối lượng muối thu được và tìm được 2 muối
- Suy ra công thức cấu tạo của 2 muối.
- Lập hệ phương trình về số mol của 2 este X, Y
=> khối lượng => thành phần % khối lượng của các este.
Hướng dẫn giải
Số mol hai este là 0,05 mol
Đặt công thức chung của 2 este là \(\overline R {\text{COO}}\overline {{R_1}} \)
\(\overline R {\text{COO}}\overline {{R_1}} + NaOH \to \overline R {\text{COO}}Na + \overline {{R_1}} OH\)
\(0,05\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,05\,\,\,\,\,\,\,\,\,\,\,\,\,0,05\)
nNaOH dư = 0,05 mol; mNaOH dư = 2,0 g
\({m_{\overline R {\text{COO}}Na}} = 5,75 - 2 = 3,75(g)\)
\({\overline M _{\overline R {\text{COO}}Na}} = \frac{{3,75}}{{0,05}} = 75(g)\)
Suy ra 2 muối là HCOONa và CH3COONa
Hai este HCOOC3H7 và CH3COOC2H5
Đặt số mol của X, Y là x và y
Ta có: x + y = 0,05 (1)
Hai muối HCOONa (x mol) và CH3COONa (y mol) có khối lượng 3,75 g
68x + 82y = 3,75 (2)
Từ (1) và (2) = y = 0,025mol
Hai este cùng CTPT và cùng số mol nên mỗi este chiếm 50% về khối lượng.
Tham khảo thêm
- doc Giải bài tập SBT Hóa 12 Bài 1: Este
- doc Giải bài tập SBT Hóa 12 Bài 2: Lipit
- doc Giải bài tập SBT Hóa 12 Bài 3: Khái niệm về xà phòng và chất giặt rửa tổng hợp