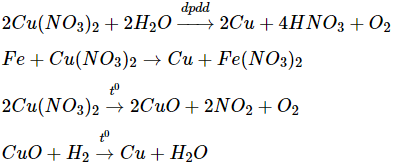Giải bài tập SBT Hóa 12 Bài 21: Điều chế kim loại
Hướng dẫn Giải bài tập Sách bài tập Hóa học 12 Bài 21 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về điều chế kim loại. Mời các em cùng theo dõi.
Mục lục nội dung
1. Giải bài 21.1 trang 46 SBT Hóa học 12
2. Giải bài 21.2 trang 46 SBT Hóa học 12
3. Giải bài 21.3 trang 46 SBT Hóa học 12
4. Giải bài 21.4 trang 46 SBT Hóa học 12
5. Giải bài 21.5 trang 46 SBT Hóa học 12
6. Giải bài 21.6 trang 47 SBT Hóa học 12
7. Giải bài 21.7 trang 47 SBT Hóa học 12
8. Giải bài 21.8 trang 47 SBT Hóa học 12
9. Giải bài 21.9 trang 47 SBT Hóa học 12
10. Giải bài 21.10 trang 47 SBT Hóa học 12
11. Giải bài 21.11 trang 47 SBT Hóa học 12
12. Giải bài 21.12 trang 47 SBT Hóa học 12
13. Giải bài 21.13 trang 48 SBT Hóa học 12
14. Giải bài 21.14 trang 48 SBT Hóa học 12
15. Giải bài 21.15 trang 48 SBT Hóa học 12
16. Giải bài 21.16 trang 48 SBT Hóa học 12
17. Giải bài 21.17 trang 48 SBT Hóa học 12
18. Giải bài 21.18 trang 48 SBT Hóa học 12
19. Giải bài 21.19 trang 48 SBT Hóa học 12
20. Giải bài 21.20 trang 49 SBT Hóa học 12
21. Giải bài 21.21 trang 49 SBT Hóa học 12
22. Giải bài 21.22 trang 49 SBT Hóa học 12

1. Giải bài 21.1 trang 46 SBT Hóa học 12
Khi điện phân có màng ngăn dung dịch muối ăn bão hoà trong nước thì xảy ra hiện tượng nào trong số các hiện tượng cho dưới đây ?
A. Khí oxi thoát ra ở catot và khí clo thoát ra ở anot.
B. Khí hiđro thoát ra ở catot và khí clo thoát ra ở anot.
C. Kim loại natri thoát ra ở catot và khí clo thoát ra ở anot.
D. Nước Gia-ven được tạo thành trong bình điện phân.
Phương pháp giải
Cần xác định hiện tượng khi điện phân có màng ngăn dung dịch muối ăn bão hoà trong nước để chọn đáp án thích hợp.
Hướng dẫn giải
Catot: +, O nước điện phân trước thu được khí hiđro
2O + 2e → 2OH− + H2
Anot: −, O,ion − điện phân trước thu được khí clo
l−→ Cl2 + 2e
=> Chọn B.
2. Giải bài 21.2 trang 46 SBT Hóa học 12
Phương pháp điều chế kim loại bằng cách dùng đơn chất kim loại có tính khử mạnh hơn để khử ion kim loại khác trong dung dịch muối được gọi là
A. phương pháp nhiệt luyện.
B. phương pháp thuỷ luyện.
C. phương pháp điện phân.
D. phương pháp thuỷ phân.
Phương pháp giải
Để chọn đáp án đúng cần ghi nhớ: Phương pháp điều chế kim loại bằng cách dùng đơn chất kim loại có tính khử mạnh hơn để khử ion kim loại khác trong dung dịch muối được gọi là phương pháp thuỷ luyện.
Hướng dẫn giải
Phương pháp thuỷ luyện: dùng dung dịch thích hợp để hòa tan kim loại hoặc hợp chất kim loại và tách phần không tan có trong quặng. Sau đó khử những ion kim loại trong dung dịch bằng kim loại có tính khử mạnh như Fe, Zn,...
=> Chọn B.
3. Giải bài 21.3 trang 46 SBT Hóa học 12
Điện phân bằng điện cực trơ dung dịch muối sunfat của kim loại hoá trị II với dòng điện có cường độ 6A. Sau 29 phút điện phân thấy khối lượng catot tăng 3,45 g. Kim loại đó là
A. Zn. B. Cu
C. Ni. D. Sn.
Phương pháp giải
- Dựa vào công thức \(m = \frac{{AIt}}{{nF}}\)
- Tìm khối lượng mol của A => Tên kim loại
Hướng dẫn giải
Catot ion kim loại điện phân trước
\(m = \frac{{AIt}}{{nF}}\) =( A.6.1740)/(2.96500) =3,45
=>64
=> Chọn B
4. Giải bài 21.4 trang 46 SBT Hóa học 12
Điện phân 200 ml dung dịch KOH 2M (D = 1,1 g/cm3) với điện cực trơ. Khi ở catot thoát ra 2,24 lít khí (đktc) thì ngừng điện phân. Biết rằng nước bay hơi không đáng kể. Dung dịch sau điện phân có nồng độ phần trăm là
A. 10,27%. B. 10,18%.
C. 10,9%. D. 38,09%.
Phương pháp giải
- Viết phương trình điện phân hai cực
- Tính khối lượng dd trước sau phản ứng và khối lượng KOH
Hướng dẫn giải
nH2 = 0,1 mol
Ở catot: 2H2O + 2e → 2OH- + H2
0,2 0,2 0,1
Ở anot: 4OH- → O2 + 4e + 2H2O
0,2 0,05 0,2
Ta thấy lượng − không đổi
mdung dịch đầu = 220.1,1 = 220 g.
msau = 220 - 0,2 - 1,6 = 218,2 (g)
C% = 22,4/218,2.100% = 10,27%
Chọn A.
5. Giải bài 21.5 trang 46 SBT Hóa học 12
Trong số những công việc sau, công việc nào không được thực hiện trong công nghiệp bằng phương pháp điện phân ?
A. Điều chế kim loại Zn.
B. Điều chế kim loại Cu.
C. Điều chế kim loại Fe.
D. Mạ niken.
Phương pháp giải
Dựa vào lí thuyết bài điều chế kim loại để trả lời.
Hướng dẫn giải
Điều chế kim loại Fe không được thực hiện trong công nghiệp bằng phương pháp điện phân
=> Chọn C.
6. Giải bài 21.6 trang 47 SBT Hóa học 12
Có thể thu được kim loại nào trong số các kim loại sau: Cu, Na, Ca, Al bằng cả 3 phương pháp điều chế kim loại phổ biến (nhiệt luyện, thuỷ luyện, điện phân) ?
A.Na. B. Ca.
C. Cu D. Al
Phương pháp giải
Cần nắm rõ các phương pháp điều chế các kim loại trên để xác định kim loại có thể thu được bằng cả 3 phương pháp điều chế kim loại phổ biến (nhiệt luyện, thuỷ luyện, điện phân).
Hướng dẫn giải
Cu được điều chế bằng ba phương pháp nhiệt luyện, thuỷ luyện, điện phân
=> Chọn C.
7. Giải bài 21.7 trang 47 SBT Hóa học 12
Dãy gồm các kim loại được điều chế trong công nghiệp bằng phương pháp điện phân hợp chất nóng chảy của chúng là
A.Na, Ca, Al. B. Na, Ca, Zn.
C. Na, Cu, Al. D. Fe, Ca, Al.
Phương pháp giải
Cần xác định các kim loại được điều chế bằng phương pháp phương pháp điện phân hợp chất nóng chảy để chọn đáp án thích hợp.
Hướng dẫn giải
Na, Ca, Al điều chế trong công nghiệp bằng phương pháp điện phân hợp chất nóng chảy của chúng.
=> Chọn A.
8. Giải bài 21.8 trang 47 SBT Hóa học 12
Cho luồng khí H2 dư qua hỗn hợp các oxit sau: CuO, Fe2O3, ZnO, MgO nung ở nhiệt độ cao. Sau phản ứng hoàn toàn hỗn hợp rắn còn lại là
A. Cu, Fe, Zn, MgO.
B. Cu, Fe, ZnO, MgO.
C. Cu, Fe, Zn, Mg.
D. Cu, FeO, ZnO, MgO.
Phương pháp giải
Cần nắm rõ hỗn hợp chất rắn thu được khi cho luồng khí H2 dư qua hỗn hợp các oxit CuO, Fe2O3, ZnO, MgO nung ở nhiệt độ cao để chọn đáp án đúng.
Hướng dẫn giải
Hiđro khử được các oxit sau nhôm=> hỗn hợp rắn sau phản ứng là Cu, Fe, Zn, MgO
=>Chọn A.
9. Giải bài 21.9 trang 47 SBT Hóa học 12
Từ mỗi chất Cu(OH)2, NaCl, FeS2, lựa chọn phương pháp thích hợp (các điều kiện khác có đủ) để điều chế ra các kim loại tương ứng. Khi đó, số phản ứng hoá học tối thiểu phải thực hiện để điều chế được 3 kim loại Cu, Na, Fe là
A. 3. B. 4.
C. 5. D. 6.
Phương pháp giải
Dựa vào phương pháp hóa học điều chế 3 kim loại Cu, Na, Fe từ Cu(OH)2, NaCl, FeS2 để xác định số phản ứng hoá học tối thiểu phải thực hiện.
Hướng dẫn giải
\(Cu{(OH)_2}\xrightarrow{{{t^o}}}CuO + {H_2}O\)
\(CuO + {H_2} \to Cu + {H_2}\)
\(NaCl\xrightarrow{{dpnc}}Na + 1/2C{l_2}\)
\(4Fe{S_2} + 11{O_2} \to 2F{e_2}{O_3} + 8S{O_2}\)
\(F{e_2}{O_3} + 3CO \to 2Fe + 3C{O_2}\)
Chọn C.
10. Giải bài 21.10 trang 47 SBT Hóa học 12
Từ các chất riêng biệt: CuSO4, CaCO3, FeS để điều chế được các kim loại Cu, Ca, Fe thì số phản ứng hoá học tối thiểu phải thực hiện là (các điều kiện khác có đủ)
A.4. B. 5.
C. 6 D. 7.
Phương pháp giải
Dựa vào phương pháp hóa học điều chế 3 kim loại Cu, Ca, Fe từ CuSO4, CaCO3, FeS để xác định số phản ứng hoá học tối thiểu phải thực hiện.
Hướng dẫn giải
\(CuS{O_4} + {H_2}O\xrightarrow{{dp{\text{dd}}}}Cu + {H_2}S{O_4} + 1/2{O_2}\)
\(CaC{O_3} + 2HCl \to CaC{l_2} + C{O_2} + {H_2}O\)
\(CaC{l_2}\xrightarrow{{dpnc}}Ca + C{l_2}\)
\(FeS + 2HCl \to FeC{l_2} + {H_2}O\)
\(FeC{l_2}\xrightarrow{{dp{\text{dd}}}}Fe + C{l_2}\)
Chọn B.
11. Giải bài 21.10 trang 47 SBT Hóa học 12
Quá trình nào sau đây là quá trình khử ?
A. Cu →Cu2++ 2e.
B. Cu2+ + 2e→ Cu.
C. Zn2+ + 1e→Zn .
D. Zn → Zn2+ + 2e.
Phương pháp giải
Cần nắm rõ bản chất của quá trình khử để chọn phản ứng phù hợp trong các phản ứng đã cho.
Hướng dẫn giải
Quá trình khử: Cu2+ + 2e → Cu
=> Chọn B.
12. Giải bài 21.12 trang 47 SBT Hóa học 12
Trong các phương pháp sau, phương pháp nào điều chế được Cu có độ tinh khiết cao từ Cu(OH)2.CuCO3 (X)?
\(A.X\xrightarrow{{HCl}}CuC{l_2}\xrightarrow{{Fedu}}Cu\)
\(B.X\xrightarrow{{{H_2}S{O_4}}}{\text{CuS}}{O_4}\xrightarrow{{dp{\text{dd}}}}Cu\)
\(C.X\xrightarrow{{HCl}}CuC{l_2}\xrightarrow{{cc}}CuC{l_2}(khan)\xrightarrow{{dpnc}}Cu\)
\(D.X\xrightarrow{{{t^o}}}CuO\xrightarrow{{ + C,{t^o}}}Cu\)
Phương pháp giải
Để chọn đáp án thích hợp cần ghi nhớ điện phân dung dịch thu được kim loại có độ tinh khiết cao hơn.
Hướng dẫn giải
Điều chế được Cu có độ tinh khiết cao từ Cu(OH)2.CuCO3 (X) từ phản ứng:
\(B.X\xrightarrow{{{H_2}S{O_4}}}{\text{CuS}}{O_4}\xrightarrow{{dp{\text{dd}}}}Cu\)
Điện phân dung dịch thu được kim loại có độ tinh khiết cao hơn
=> Chọn B.
13. Giải bài 21.13 trang 48 SBT Hóa học 12
Trong phương pháp thủy luyện dùng để điều chế Ag từ quặng có chứa Ag2S, cần dùng
A. dung dịch HNO3 đặc và Zn.
B. dung dịch H2SO4 đặc, nóng và Zn.
C. dung dịch NaCN và Zn.
D.dung dịch HCl đặc và Zn
Phương pháp giải
Để chọn đáp án thích hợp cần ghi nhớ: Trong phương pháp thủy luyện dùng để điều chế Ag từ quặng có chứa Ag2S, cần dùng dung dịch NaCN và Zn.
Hướng dẫn giải
Trong phương pháp thủy luyện dùng để điều chế Ag từ quặng có chứa Ag2S, cần dùng dung dịch NaCN và Zn
=> Chọn C.
14. Giải bài 21.14 trang 48 SBT Hóa học 12
Trong quá trình điện phân, các anion di chuyển về
A. catot, ở đây chúng bị oxi hoá.
B. anot, ở đây chúng bị khử
C. anot, ở đây chúng bị oxi hoá.
D. catot, ở đây chúng bị khử.
Phương pháp giải
Để chọn đáp án thích hợp cần ghi nhớ: Trong quá trình điện phân, các anion di chuyển về anot, ở đây chúng bị oxi hóa
Hướng dẫn giải
Trong quá trình điện phân, các anion di chuyển về anot, ở đây chúng bị oxi hóa
=> Chọn C.
15. Giải bài 21.15 trang 48 SBT Hóa học 12
Trong quá trình điện phân dung dịch CuCl2 bằng điện cực trơ :
A. ion Cu2+ nhường electron ở anot.
B. ion Cu2+ nhận electron ở catot.
C. ion Cl- nhận electron ở anot.
D. ion Cl- nhường electron ở catot.
Phương pháp giải
Cần nắm bản chất quả quá trình điện phân dung dịch CuCl2 bằng điện cực trơ để chọn đáp án đúng.
Hướng dẫn giải
Trong quá trình điện phân dung dịch CuCl2 bằng điện cực trơ ion Cu2+ nhận electron ở catot.
=> Chọn B.
16. Giải bài 21.16 trang 48 SBT Hóa học 12
Trong quá trình điện phân dung dịch NaCl bằng điện cực trơ có màng ngăn :
A. cation Na+ bị khử ở catot.
B. phân tử H2O bị khử ở catot.
C. ion Cl- bị khử ở anot.
D. phân tử H2O bị oxi hoá ở anot.
Phương pháp giải
Cần nắm bản chất quả quá trình điện phân dung dịch NaCl bằng điện cực trơ có màng ngăn để chọn đáp án đúng.
Hướng dẫn giải
Trong quá trình điện phân dung dịch NaCl bằng điện cực trơ có màng ngăn phân tử H2O bị khử ở catot
=> Chọn B.
17. Giải bài 21.17 trang 48 SBT Hóa học 12
Trong quá trình điện phân dung dịch CuSO4 với các điện cực bằng Cu, nhận thấy :
A. nồng độ ion Cu2+ trong dung dịch tăng dần.
B. nồng độ ion Cu2+ trong dung dịch giảm dần.
C. nồng độ Cu2+ trong dung dịch không thay đổi.
D. chỉ có nồng độ ion SO42- là thay đổi.
Phương pháp giải
Cần nắm bản chất quả quá trình điện phân dung dịch CuSO4 với các điện cực bằng Cu để chọn đáp án đúng
Hướng dẫn giải
Trong quá trình điện phân dung dịch CuS04 với các điện cực bằng Cu, nhận thấy nồng độ ion Cu2+ trong dung dịch không đổi do ở cực âm quá trình khử ion đồng, cực dương quá trình oxi hóa đồng.
=> Chọn C.
18. Giải bài 21.18 trang 48 SBT Hóa học 12
Trong quá trình điện phân dung dịch CuSO4 với các điện cực bằng graphit, nhận thấy
A. nồng độ ion Cu2+ trong dung dịch tăng dần.
B. nồng độ ion Cu2+ trong dung dịch giảm dần.
C. nồng độ ion Cu2+ trong dung dịch không thay đổi.
D. chỉ có nồng độ ion SO42- là thay đổi.
Phương pháp giải
Cần ghi nhớ: Trong quá trình điện phân dung dịch CuSO4 với các điện cực bằng graphit, nhận thấy nồng độ ion Cu2+ trong dung dịch giảm dần.
Hướng dẫn giải
Trong quá trình điện phân dung dịch CuSO4 với các điện cực bằng graphit, nhận thấy nồng độ ion Cu2+ trong dung dịch giảm dần do cực âm quá trình khử ion đồng còn cực dương quá trình oxi hóa nước.
=> Chọn B.
19. Giải bài 21.19 trang 48 SBT Hóa học 12
Hỗn hợp X gồm Fe, FeO, Fe2O3. Cho một luồng khí CO đi qua ống sứ đựng m g hỗn hợp X nung nóng. Sau khi kết thúc thí nghiệm thu được 64 g chất rắn A và 11,2 lít khí B( đktc) có tỉ khối so với hiđro là 20,4. Giá trị của a là
A. 105,6 B. 35,2
C. 70,4 C. 140,8
Phương pháp giải
- Tính số mol ,CO2
- Bảo toàn khối lượng để tìm khối lượng X
Hướng dẫn giải
Khí B gồm : x mol, CO2: y mol
= 0,5 mol
x + y =0,5 (1)
\(\overline M = \frac{{28x + 44y}}{{x + y}}\)
=>12,8x -3,2y =0 (2)
Từ (1), (2) ta có x = 0,1 mol; y= 0,4 mol
ư=nCO2 =0,4 mol
BTKL ư + mX = mA + mCO2
=> = 64−0.4(44−28)=70,4 g.
=> Chọn C.
20. Giải bài 21.20 trang 49 SBT Hóa học 12
Từ những hợp chất riêng biệt : Cu(OH)2, MgO, FeS2, hãy nêu phương pháp thích hợp để điều chế Cu, Mg, Fe. Viết phương trình hoá học của các phản ứng.
Phương pháp giải
Đưa các hợp chất ban đầu về hợp chất mới
=>Chọn các phương pháp thủy luyện, nhiệt luyện, điện phân để điều chế các kim loại.
Hướng dẫn giải
\(Cu{(OH)_2} + HCl \to CuC{l_2} + {H_2}O\)
\(CuC{l_2}\xrightarrow{{dp{\text{dd}}}}Cu + C{l_2}\)
\(MgO + 2HCl \to MgC{l_2} + {H_2}O\)
\(MgC{l_2}\xrightarrow{{dp{\text{dd}}}}Mg + C{l_2}\)
\(4Fe{S_2} + 11{O_2} \to 2F{e_2}{O_3} + 8S{O_2}\)
\(F{e_2}{O_3} + 3CO \to 2Fe + 3C{O_2}\)
21. Giải bài 21.21 trang 49 SBT Hóa học 12
Bằng những phương pháp nào người ta có thể điều chế Cu từ dung dịch Cu(NO3)2, Ca từ dung dịch CaCl2? Viết phương trình hoá học của các phản ứng.
Phương pháp giải
Dựa vào lí thuyết bài điều chế kim loại để viết phương trình hoá học của các phản ứng điều chế Cu từ dung dịch Cu(NO3)2, Ca từ dung dịch CaCl2
Hướng dẫn giải
- Điều chế Cu từ Cu(NO3)2:
\(2Cu{(N{O_3})_2} + 2{H_2}O\xrightarrow{{dp{\text{dd}}}}2Cu + 4HN{O_3} + {O_2}\)
\(Fe + Cu{(N{O_3})_2} \to Cu + Fe{(N{O_3})_2}\)
\(2Cu{(N{O_3})_2}\xrightarrow{{{t^o}}}2CuO + 2N{O_2} + {O_2}\)
\(CuO + {H_2}\xrightarrow{{{t^o}}}Cu + {H_2}O\)
Điều chế Ca từ CaCl2 : cô cạn dung dịch CaCl2 rồi điện phân nóng chảy.
\(CaC{l_2}\xrightarrow{{dpnc}}Ca + C{l_2}\)
22. Giải bài 21.22 trang 49 SBT Hóa học 12
Trình bày phương pháp hoá học điều chế các kim loại Ca, Na, Cu từ những muối riêng biệt: CaCO3, Na2SO4, Cu2S.
Phương pháp giải
Dựa vào lý thuyết về điều chế kim loại để phương pháp hoá học điều chế các kim loại Ca, Na, Cu từ những muối riêng biệt: CaCO3, Na2SO4, Cu2S.
Hướng dẫn giải
\(CaC{O_3}\xrightarrow{{HCl}}CaC{l_2}\xrightarrow{{dpnc}}Ca\)
\(N{a_2}S{O_4}\xrightarrow{{BaC{l_2}}}NaCl\xrightarrow{{dpnc}}Na\)
\(C{u_2}S\xrightarrow{{{O_2}}}CuO\xrightarrow{{{H_2}}}Cu\)
23. Giải bài 21.23 trang 49 SBT Hóa học 12
Từ các chất riêng biệt : CuSO4, CaCO3, FeS cần điều chế được các kim loại Cu, Ca, Fe. Viết PTHH của các phản ứng xảy ra. (Các điều kiện khác có đủ).
Phương pháp giải
Dựa vào lý thuyết về điều chế kim loại để phương pháp hoá học điều chế các kim loại Ca, Na, Cu từ những muối riêng biệt: CuSO4, CaCO3, FeS
Hướng dẫn giải
Điều chế Cu:
\(2CuS{O_4} + 2{H_2}O\xrightarrow{{dp{\text{dd}}}}2Cu + {O_2} + 2{H_2}S{O_4}\)
Điều chế Ca:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
\(CaC{l_2}\xrightarrow{{dpnc}}Ca + C{l_2}\)
Điều chế Fe:
FeS+ 2HCl → FeCl2 + H2S
\(FeC{l_2}\xrightarrow{{dp{\text{dd}}}}Fe + C{l_2}\)
24. Giải bài 21.24 trang 49 SBT Hóa học 12
Điện phân (điện cực trơ) dung dịch X chứa 0,2 mol CuSO4 và 0,12 mol NaCl bằng dòng điện có cường độ 2A. Tính thể tích khí (đktc) thoát ra ở anot sau 9650 giây điện phân.
Phương pháp giải
- Xác định ion điện phân trước=>ghép các ion để viết phương trình phân tử
- Cl2 điện phân trước=> thời gian điện phân Cl2 và số mol khí ở anot
- Tính thời gian điện phân SO4 => Khối lượng khí oxi thu được anot
=> Tổng số mol khí anot
Hướng dẫn giải
Trong quá trình điện phân cation nào có tính oxi hoá mạnh hơn sẽ thu e trước, anion nào có tính khử mạnh hơn sẽ nhường e trước. Trong dung dịch đã cho thứ tự như sau :
- Ở catot: Cu2+ > H+(H2O) > Na+
- Ở anot: Cl- > OH-(H2O) > SO42-
Ghép các ion thành phân tử để viết pt điện phân. Các ion Cl- và Cu2+ điện phân trước.
\(CuC{l_2}\xrightarrow{{dp{\text{dd}}}}Cu + C{l_2}\) (1)
\(2CuS{O_4} + 2{H_2}O\xrightarrow{{dp{\text{dd}}}}2Cu + {O_2} + 2{H_2}S{O_4}\) (2)
Thời gian cần thiết để điện phân ở (1):
\(m = \frac{{AIt}}{{nF}} \to t = \frac{{mnF}}{{AI}} = \frac{{71.0,06.2.96500}}{{2.71}} = 5790(s)\)
Thời gian còn lại để điện phân (2) là: 9650- 5790= 3860 (s)
Tính khối lượng O2 thu được khi điện phân trong 3860 s:
\(m = \frac{{AIt}}{{nF}} = \frac{{32.2.3860}}{{4.96500}} = 0,64g\)
\({n_{{O_2}}} = \frac{{0,64}}{{32}} = 0,02mol\)
Tổng số mol khí thu được ở anot là: 0,06+0,02=0,08 mol
Thể tích khí thu được ở anot là: 0,08.22,4=1,792 (l)
Tham khảo thêm
- doc Giải bài tập SBT Hóa 12 Bài 17: Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại
- doc Giải bài tập SBT Hóa 12 Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại
- doc Giải bài tập SBT Hóa 12 Bài 19: Hợp kim
- doc Giải bài tập SBT Hóa 12 Bài 20: Sự ăn mòn kim loại
- doc Giải bài tập SBT Hóa 12 Bài 22: Luyện tập Tính chất của kim loại
- doc Giải bài tập SBT Hóa 12 Bài 23: Luyện tập Điều chế kim loại và sự ăn mòn kim loại