10 đề thi giữa HK1 môn Hóa học 11 năm 2021-2022 có đáp án
Cùng tham gia thử sức với bộ 10 đề thi giữa HK1 môn Hóa 11 năm 2021-2022 có đáp án để nâng cao tư duy, rèn luyện kĩ năng giải đề và củng cố kiến thức căn bản. Chúc các em vượt qua kì thi sắp tới thật dễ dàng nhé!
Mục lục nội dung

1. Đề cương ôn tập giữa HK1 môn Hóa học 11
A. KIẾN THỨC CƠ BẢN
a. Axít, bazơ và muối
1. Axit khi tan trong nước phân li ra caction H+; Bazơ khi tan trong nước phân li ra anion OH-
2. Chất lưỡng tính vừa thể hiện tính axit, vừa thể hiện tính bazơ.
3. Hầu hết các muối khi tan trong nước phân li ra cation kim loại (hoặc cation NH4+) và anion gốc axit.
4. Nếu gốc axit còn chứa hidro có tính axit, thì gốc đó tiếp tục phân li yếu ra cation H+ và anion gốc axit.
5. Tích số ion của nước là KHO= [H+] [OH] = 1,0 . 10-14. Một cách gần đúng có thể coi giá trị của tích số này là hằng số cả trong dung dịch loãng của các chất khác nhau.
Giá trị [H+] và pH đặc trưng cho các môi trường :
- Môi trường trung tính: [H+] = 1,0 . 10-7M hay pH = 7,00
- Môi trường axit : [H+] > 1,0 . 10-7M hay pH < 7,00
- Môi trường kiềm : [H+] < 1,0 . 10-7M hay pH > 7,00
6. Màu của quỳ, phenolphtalein và chất chỉ thị vạn năng trong dịch ở các giá trị pH khác nhau (xem SGK)
b. Phản ứng trao đổi ion trong dung dịch các chất điện li
- Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất một trong các chất sau :
a) Chất kết tủa.
b) Chất điện li yếu.
c) Chất khí.
Phương trình ion rút gọn cho biết bản chất của phản ứng trong dung dịch các chất điện li. Trong phương trình ion rút gọn của phản ứng, người ta lược bỏ những ion không tham gia phản ứng, còn những chất kết tủa, điện li yếu, chất khí được giữ nguyên dưới dạng phân tử.
c. Tính chất của nitơ và hợp chất của nitơ
- Đơn chất Nitơ
- Cấu hình electron nguyên tử: 1s22s22p3. Các số oxi hóa: -3, 0, +1, +2, +3, +4, +5.
- Phân tử N2 chứa liên kết ba bền vững (N ≡ N) nên nitơ khá trơ ở điều kiện thường.
- Hợp chất của nitơ
+ Amoniac: Amoniac là chất khí tan rất nhiều trong nước.
Tính bazơ yếu
+ Muối amoni
- Dễ tan trong nước, là chất điện li mạnh
- Trong dung dịch, ion NH4+ là axit yếu: NH + H2O → NH3+H3O
- Tác dụng với dung dịch kiểm tạo ra khí amoniac.
- Dễ bị nhiệt phân hủy.
+ Axit nitric
- Là axit mạnh
- Là chất oxi hóa mạnh. +4 +2 +1 0 -3
– HNO3 oxi hóa được hầu hết các kim loại. Sản phẩm của phản ứng có thể là NO2, NO, N2O, N2, NH4NO3, tùy thuộc nồng độ của axit và tính khử mạnh hay yếu của kim loại.
– HNO3 đặc oxi hóa được nhiều phi kim và các hợp chất có tính khử .
+ Muối nitrat
- Dễ tan trong nước, là chất điện li mạnh.
- Dễ bị nhiệt phân hủy.
B. BÀI TẬP LUYỆN TẬP
Câu 1:Chất nào sau đây thuộc loại chất điện li mạnh?
A. CH3COOH.
B. C2H5OH.
C. H2O.
D. NaCl.
Câu 2: Dãy chất nào sau đây, trong nước đều là chất điện li mạnh ?
A. H2SO4, Cu(NO3)2, CaCl2, NH3.
B. HCl, H3PO4, Fe(NO3)3, NaOH.
C. HNO3, CH3COOH, BaCl2, KOH.
D.H2SO4, MgCl2, Al2(SO4)3, Ba(OH)2.
Câu 3: Dãy chất nào sau đây, trong nước đều là chất điện li yếu:
A. H2CO3, H2SO3, Al2(SO4)3.
B. H2CO3, H2S, CH3COOH.
C. H2S, CH3COOH, Ba(OH)2.
D. H2S, H2SO3, H2SO4.
Câu 4: Dung dịch nào sau đây dẫn điện được:
A. Dung dịchmuối ăn
B. Dung dịch ancol
C. Dung dịch đường
D. Dung dịchbenzen trong ancol
Câu 5: Phương trình điện li nào sau đây không đúng?
A. CH3COOH → CH3COO+ H+.
B. Na2SO4 → 2Na+ + SO.
C. Mg(OH)2 → Mg2++ 2OH.
D. Ba(OH)2 → Ba2+ + 2OH.
Câu 6: Muối nào sau đây không phải là muối axit?
A. NaHSO4.
B. Ca(HCO3)2
C. Na2HPO3.
D. Na2HPO4.
Câu 7: Dung dịch thu được khi trộn lẫn 200 ml dung dịch NaCl 0,2M và 300 ml dung dịch Na2SO4 0,2M có nồng độ cation Na+ là bao nhiêu?
A. 0,23M.
B. 1M.
C. 0,32M
D. 0,1M.
Câu 8: Dung dịch X chứa HCl 0,06M và H2SO4 0,02M. pH của dung dịch X là:
A. 13.
B. 12.
C. 1.
D. 2.
Câu 9: Trộn 100 ml dung dịch gồm Ba(OH)2 0,1M và NaOH 0,1M với 400 ml dung dịch gồm H2SO4 0,0375M và HCl 0,0125M thu được dung dịch X.Giá trị pH của dung dịch X là:
A.7.
B.2.
C.1.
D.6.
Câu 10: Phương trình ion rút gọn H+ + OH- → H2O biểu diễn bản chất của phản ứng hóa học nào sau đây?
A. 3HCl + Fe(OH)3 → FeCl3+ 3H2O.
B. HCl + NaOH → NaCl + H2O.
C. NaOH + NaHCO3→ Na2CO3+ H2O.
D. H2SO4 + Ba(OH)2 → BaSO4 + 2H2O.
Câu 11: Dãy nào cho dưới đây gồm các ion cùng tồn tại trong một dung dịch?
A. Na+, NH, Al3+, SO, OH-, Cl.
B. Ca2+, K+, Cu2+, NO, OH, Cl.
C. Ag+, Fe3+, H+, Br, CO, NO.
D. Na+, Mg2+, NH, SO, Cl, NO.
Câu 12: Các ion nào sau không thể cùng tồn tại trong một dung dịch?
A. Na+, Mg2+, NO, SO.
B. Ba2+, Al3+, Cl–, HSO.
C. Cu2+, Fe3+, SO, Cl– .
D. K+, NH, SO42–, PO.
Câu 13 Trong công nghiệp, người ta thường điều chế N2 từ
A. amoniac.
B. axit nitric.
C. không khí.
D. amoni nitrat.
Câu 14: Axit HNO3 tinh khiết là chất lỏng không màu, dễ bị phân hủy khi chiếu sáng vì vậy người ta đựng nó trong bình tối màu. Trong thực tế bình chứa dung dịch HNO3 đậm đặc thường có màu vàng vì nó có hòa lẫn một ít khí X. Vậy X là khí nào sau đây?
A. NH3.
B. Cl2.
C. N2O.
D. NO2.
Câu 15: Phân bón nào sau đây làm tăng độ chua của đất?
A. KCl
B. NH4NO3.
C. NaNO3.
D. K2CO3.
Câu 16: Trong phản ứng của photpho với (1) Ca, (2) O2, (3) Cl2, (4) KClO3. Những phản ứng trong đó photpho thể hiện tính khử là
A. (1), (2), (4).
B. (1), (3).
C. (2), (3), (4).
D. (1), (2), (3).
Câu 17: Axit H3PO4 và HNO3 cùng phản ứng được với tất cả các chất trong dãy nào dưới đây?
A. CuCl2, KOH, NH3, Na2CO3.
B. KOH, NaHCO3, NH3, ZnO.
C. MgO, BaSO4, NH3, Ca(OH)2.
D. NaOH, KCl, NaHCO3, H2S.
Câu 18: Khi bị nhiệt phân dãy muối nitrat nào sau đây cho sản phẩm là oxit kim loại, khí nitơ đioxit và oxi?
A. Cu(NO3)2, AgNO3, NaNO3.
B. KNO3, Hg(NO3)2, LiNO3.
C. Pb(NO3)2, Zn(NO3)2, Cu(NO3)2.
D. Mg(NO3)2, Fe(NO3)3, AgNO3.
Câu 19: Cho 200 ml dung dịch NaOH 1M tác dụng với 200 ml dung dịch H3PO4 0,5M, muối thu được có khối lượng là
A. 14,2 gam.
B. 15,8 gam.
C. 16,4 gam.
D. 11,9 gam.
Câu 20: Cho 1,86 gam hỗn hợp Al và Mg tác dụng với dung dịch HNO3 loãng dư, thu được 560 ml lít khí N2O (đktc, sản phẩm khử duy nhất) bay ra. Khối lượng muối nitrat tạo ra trong dung dịch là
A. 40,5 gam.
B. 14,62 gam.
C. 24,16 gam.
D. 14,26 gam.
Câu 21: Cho 2,16 gam Mg tác dụng với dung dịch HNO3 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,896 lít khí NO ở điều kiện tiêu chuẩn và dung dịch X. Khối lượng muối khan thu được khi làm bay hơi dung dịch X là
A. 13,32 gam.
B. 6,52 gam.
C. 13,92 gam
D. 8,88 gam.
2. Đề thi giữa học kì 1
2.1. Đề thi giữa HK1 môn Hóa học 11 – Số 1
TRƯỜNG THPT NHO QUAN
ĐỀ THI GIỮA HK1
NĂM HỌC: 2021-2022
MÔN: HÓA HỌC 11
Thời gian: 45 phút (không kể thời gian giao đề)
Phần I: Trắc nghiệm:
Câu 1: Cho dãy các chất sau: HCl, H2SO4, H3PO4, NaOH, C2H5OH, Ba(OH)2, Fe(NO3)3, NH4Cl, KAlO2. Số chất điện li mạnh là:
A. 6 B. 7 C. 8 D. 9
Câu 2: Cho các chất sau: KOH, Ca(OH)2, Al(OH)3, Zn(OH)2, Sn(OH)2 và Pb(OH)2. Số chất có tính chất lưỡng tính là:
A. 2. B. 3 C. 4 D. 5
Câu 3: Khi trộn 100 ml dung dịch Ba(OH)2 0,125M với 400 ml dung dịch HCl 0,05M thu được dung dịch có pH là:
A. 2 B. 6 C. 10 D. 12
Câu 4: Dãy gồm các ion có thể cùng tồn tại trong một dung dịch là:
A. NH4+, NO3-, HCO3-, OH-
B. K+, H+, SO42-, OH-
C. Na+, NH4+, H+, CO32-
D. Ca2+, Fe2+, NO3-, Cl-
Câu 5: Thể tích dung dịch HNO3 0,3M vừa đủ để trung hòa 100 ml dung dịch chứa hỗn hợp NaOH 0,1M và Ba(OH)2 0,1M là
A. 100 ml B. 150 ml C. 200 ml D. 250 ml
Câu 6: Cho phản ứng hóa học NaOH + HCl → NaCl + H2O. Phản ứng hóa học nào sau đây có cùng phương trình ion rút gọn với phản ứng trên?
A. 2KOH + FeCl2 → Fe(OH)2 + 2KCl
B. NaOH + NaHCO3 → Na2CO3 + H2O
C. NaOH + NH4Cl → NaCl + NH3 + H2O
D. KOH + HNO3 → KNO3 + H2O
Câu 7: Cho thí nghiệm như hình vẽ, bên trong bình có chứa khí NH3, trong chậu thủy tinh chứa nước có nhỏ vài giọt phenolphthalein. Hiện tượng xảy ra trong thí nghiệm là:
A. Nước phun vào bình và chuyển thành màu xanh.
B. Nước phun vào bình và chuyển thành màu hồng.
C. Nước phun vào bình và không có màu.
D. Nước phun vào bình và chuyển thành màu tím.
Câu 8: Hòa tan hoàn toàn 13 gam Zn trong dung dịch HNO3 loãng, dư thu được dung dịch X và 0,448 lít khí N2 (đktc). Khối lượng muối trong dung dịch X là:
A. 37,8 gam B. 18,9 gam C. 28,35 gam D. 39,8 gam
Câu 9: Dung dịch X gồm a mol Na+; 0,15 mol K+; 0,1 mol HCO3-; 0,15 mol CO32- và 0,05 mol SO42-. Tổng khối lượng muối trong dung dịch X là:
A. 33,8 gam B. 28,5 gam C. 29,5 gam D. 31,3 gam
Câu 10: Cho 3,2 gam Cu tác dụng với 100 ml dung dịch gồm HNO3 0,8M và H2SO4 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, sinh ra V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là:
A. 0,448 B. 0,792 C. 0,672 D. 0,746
Phần II: Tự luận.
Câu 1: Chỉ dùng một hóa chất, hãy trình bày phương pháp hóa học phân biệt ba dung dịch sau đụng trong các lọ mất nhãn sau: NH4Cl, (NH4)2SO4 và KNO3. Viết các phương trình hóa học xảy ra.
Câu 2: Viết phương trình phản ứng thực hiện dãy biến hóa sau (ghi rõ điều kiện nếu có)
NH4NO2 → N2 → NH3 → NO → NO2 → HNO3 → Cu(NO3)2 → O2 → Al(OH)3
Câu 3: Hòa tan hoàn toàn 23,6 gam hỗn hợp gồm Cu và Fe vào dung dịch HNO3 2M (dư), thu được dung dịch A và 7,84 lít khí NO (sản phẩm khử duy nhất ở đktc)
1. Tính thành phần % khối lượng mỗi kim loại trong hỗn hợp đầu.
2. Tính khối lượng muối khan thu được khi cô cạn dung dịch A.
3. Tính thể tích của dung dịch HNO3 ban đầu (biết rằng dùng dư 10% so với lượng cần phản ứng)
ĐÁP ÁN ĐỀ SỐ 1
Phần I. Trắc nghiệm.
1. B 2. C
3. D 4. D
5. A 6. D
7. B 8. D
9. A 10. C
Phần 2: Tự luận.
Câu 1
- Dùng dung dịch Ba(OH)2
- Trình bày lời đúng cho 1,0 điểm.
- Viết phương trình phản ứng đúng cho 1,0 điểm
Câu 2: Mỗi phương trình đúng cho 0,25 điểm
Câu 3
1. 2,0 điểm.
- Viết phương trình phản ứng đúng cho 0,5 điểm
- Lập hệ phương trình đúng cho 0,5 điểm
- Giải hệ phương trình ra số mol Fe = 0,25 mol. Số mol Cu = 0,15 cho 0,5 điểm
- Tính ra % Fe = 59,32%, % Cu = 40,68% cho 0,5 điểm
2. Tìm ra khối lượng 2 muối = 88,7 gam. Cho 0,75 điểm
3. Số mol HNO3 = 1,4 mol, thể tích HNO3 đủ = 0,7 lít, thể tích HNO3 dư 10% = 0,77 lít
2.2. Đề thi giữa HK1 môn Hóa học 11 – Số 2
TRƯỜNG THPT NGUYỄN THƯỢNG HIỀN
ĐỀ THI GIỮA HK1
NĂM HỌC: 2021-2022
MÔN: HÓA HỌC 11
Thời gian: 45 phút (không kể thời gian giao đề)
Câu 1: Đốt cháy hòan toàn a mol axit hữu cơ Y được 2a mol CO2. Mặt khác để trung hòa a mol Y cần vừa đủ 2a mol NaOH. Công thức cấu tạo thu gọn của Y là
A. HOOC-CH2-CH2-COOH.
B. C2H5-COOH.
C. CH3COOH.
D. HOOC-COOH.
Câu 2: Dãy gồm các chất có thể điều chế trực tiếp (bằng một phản ứng) tạo ra axit axetic là
A. C2H4(OH)2, CH3OH, CH3CHO.
B. CH3CHO, C2H5OH, C2H5COOCH3
C. CH3OH, C2H5OH, CH3CHO.
D. CH3CHO, C6H12O6 (glucozơ), CH3OH.
Câu 3: Hai hợp chất hữu cơ X, Y có cùng công thức phân tử C3H6O2. Cả X và Y đều tác dụng với Na; X tác dụng được với NaHCO3 còn Y có khả năng tham gia phản ứng tráng bạc. Công thức cấu tạo của X và Y lần lượt là
A. C2H5COOH và CH3CH(OH)CHO.
B. C2H5COOH và HCOOC2H5.
C. HCOOC2H5và HOCH2CH2CHO.
D. HCOOC2H5 và HOCH2COCH3.
Câu 4: Cho các chất HCl (X); C2H5OH (Y); CH3COOH (Z); C6H5OH (phenol) (T). Dãy gồm các chất được sắp xếp theo chiều tính axit tăng dần (từ trái sang phải) là
A. (X), (Z), (T), (Y).
B. (Y), (T), (Z), (X).
C. (Y), (T), (X), (Z).
D. (T), (Y), (X), (Z).
Câu 5: Cho sơ đồ chuyển hóa: CH3CH2Cl → X → Y.
Công thức cấu tạo của X, Y lần lượt là:
A. CH3CH2CN, CH3CH2CHO.
B. CH3CH2NH2, CH3CH2COOH.
C. CH3CH2CN, CH3CH2COONH4.
D. CH3CH2CN, CH3CH2COOH.
Câu 6: Dãy gồm các chất được sắp xếp theo chiều tăng dần nhiệt độ sôi từ trái sang phải là
A. CH3CHO, C2H5OH, HCOOH, CH3COOH.
B. CH3COOH, HCOOH, C2H5OH, CH3CHO.
C. HCOOH, CH3COOH, C2H5OH, CH3CHO
D. CH3COOH, C2H5OH, HCOOH, CH3CHO.
Câu 7: Khi cho a mol một hợp chất hữu cơ X (chứa C, H, O) phản ứng hoàn toàn với Na hoặc với NaHCO3 thì đều sinh ra a mol khí. Chất X là
A. etylen glicol.
B. axit 3-hiđroxipropanoic.
C. axit ađipic.
D. Ancol o-hiđroxibenzylic.
Câu 8: Hai chất X và Y có cùng công thức phân tử C2H4O2. Chất X phản ứng được với kim loại Na và tham gia phản ứng tráng bạc. Chất Y phản ứng được với kim loại Na và hoà tan được CaCO3. Công thức của X, Y lần lượt là
A. HOCH2CHO, CH3COOH.
B. HCOOCH3, HOCH2CHO.
C. CH3COOH, HOCH2CHO.
D. HCOOCH3, CH3COOH.
Câu 9: Tổng số hợp chất hữu cơ no, đơn chức, mạch hở, có cùng công thức phân tử C5H10O2, phản ứng được với dung dịch NaOH nhưng không có phản ứng tráng bạc là
A. 4.
B. 5.
C. 8.
D. 9.
Câu 10: Cho 4 axit CH3COOH (X); Cl2CHCOOH (Y); ClCH2COOH (Z); BrCH2COOH (T). Chiều tăng dần tính axit của các axit trên là
A. Y, Z, T, X.
B. X, Z, T, Y.
C. X, T, Z, Y.
D. T, Z, Y, X.
Câu 11: Dãy gồm các chất xếp theo chiều lực axit tăng dần từ trái sang phải là
A. HCOOH, CH3COOH, CH3CH2COOH.
B. CH3COOH, HCOOH, (CH3)2CHCOOH
C. C6H5OH, CH3COOH, CH3CH2OH.
D. CH3COOH, CH2ClCOOH, CHCl2COOH.
Câu 12: Cho sơ đồ phản ứng:
(X, Z, M là các chất vô cơ, mỗi mũi tên ứng với một phương trình phản ứng).
Chất T trong sơ đồ trên là
A. C2H5OH.
B. CH3COONa.
C. CH3CHO.
D. CH3OH.
Câu 13: Hai chất hữu cơ X, Y có thành phần phân tử gồm C, H, O (MX < MY < 82). Cả X và Y đều có khả năng tham gia phản ứng tráng bạc và đều phản ứng được với dung dịch KHCO3 sinh ra khí CO2. Tỉ khối hơi của Y so với X có giá trị là
A. 1,47.
B. 1,61.
C. 1,57.
D. 1,91.
Câu 14: Đốt cháy hoàn toàn x mol axit cacboxylic E, thu được y mol CO2 và z mol H2O (với z = y – x). Cho x mol E tác dụng với NaHCO3 (dư) thu được y mol CO2. Tên của E là
A. axit acrylic.
B. Axit oxalic.
C. axit ađipic.
D. axit fomic.
Câu 15: Cho sơ đồ phản ứng:
(1) CH3CHO → X1 → X2
(2) C2H5Br → Y1→ Y2 → Y3
Các chất hữu cơ X1, X2, Y1, Y2, Y3 là các sản phẩm chính. Hai chất X2, Y3 lần lượt là
A. axit 3-hiđroxipropanoic và ancol propylic.
B. axit axetic và ancol propylic.
C. axit 2-hiđroxipropanoic và axit propanoic.
D. axit axetic và axit propanoic.
Câu 16: Cho các chất hữu cơ: CH3CH(CH3)NH2 (X) và CH3CH(NH2)COOH (Y). Tên thay thế của X và Y lần lượt là
A. propan-2-amin và axit aminoetanoic.
B. propan-2-amin ; axit 2-aminopropanoic.
C. propan-1-amin và axit 2-aminopropanoic.
D. propan-1-amin và axit aminoetanoic.
Câu 17: Chất nào sau đây vừa tác dụng được với dung dịch NaOH, vừa tác dụng được với nước Br2?
A. CH3CH2CH2OH.
B. CH3COOCH3.
C. CH3CH2COOH.
D. CH2=CHCOOH.
Câu 18: Cho dãy các chất: etan, etanol, etanal, axit etanoic. Chất có nhiệt độ sôi cao nhất trong dãy là
A. etanal.
B. etan.
C. etanol.
D. axit etanoic.
Câu 19: Trong phân tử axit cacboxylic X có số nguyên tử cacbon bằng số nhóm chức. Đốt cháy hoàn toàn một lượng X thu được số mol CO2 bằng số mol H2O. Tên gọi của X là
A. axit axetic.
B. axit oxalic.
C. axit fomic.
D. axit malonic.
Câu 20: Cho sơ đồ chuyển hóa: CH3Cl→ X → Y.
Công thức cấu tạo X, Y lần lượt là
A. CH3NH2, CH3COOH.
B. CH3CN, CH3CHO.
C. CH3CN, CH3COOH.
D. CH3NH2, CH3COONH4.
---Để xem tiếp nội dung từ câu 21-30 của Đề thi số 2, các em vui lòng xem online hoặc tải về máy tính--
2.3. Đề thi giữa HK1 môn Hóa học 11 – Số 3
TRƯỜNG THPT QUANG TRUNG
ĐỀ THI GIỮA HK1
NĂM HỌC: 2021-2022
MÔN: HÓA HỌC 11
Thời gian: 45 phút (không kể thời gian giao đề)
Câu 1: Dung dịch CH3COOH 0,1M phải có
A. pH < 1 B. pH > 7 C. pH = 7 D. 1 < pH < 7
Câu 2: Dung dịch KOH 0,0001M có pH bằng:
A. 11 B. 3 C. 4 D. 10
Câu 3: Nhận xét nào sau đây sai ?
A. Dung dịch axit có chứa ion H+ .
B. Dung dịch HNO3 có [ H+] > 10-7M
C. Dung dịch bazơ có chứa ion OH –
D. Dung dịch muối không bao giờ có tính axit hoặc bazơ.
Câu 4: Nếu trộn 100 ml dung dịch HCl 0,01M với 100 ml dung dịch H2SO4 0,005M thì dung dịch thu được có pH là (Biết H2O bay hơi không đang kể):
A. 2 B. 3,12 C. 4 D. 1
Câu 5: Phương trình điện li nào sau đây viết sai ?
A. Na2SO4 → Na2+ + SO42 –
B. Fe(NO3)3 → Fe3+ + 3NO3–
C. Al2(SO4)3 → 2Al3+ + 3SO42–
D. K2CrO4 → K+ + CrO42 –
Câu 6: Phương trình phân tử: CaCO3 + 2HCl → CaCl2 + CO2 + H2O có phương trình ion rút gọn sau?
A. CaCO3 + 2H + → Ca2+ + CO2 + H2O.
B. Ca2+ + 2Cl – → CaCl2 .
C. 2H+ + CO32– → CO2 + H2O.
D. CaCO3 + 2H+ + 2Cl – → CaCl2 + CO2 + H2O.
Câu 7: Phản ứng nào sau đây không phải là phản ứng axit–bazơ ?
A. H2SO4 + BaCl2 → BaSO4 + 2HCl
B. H2SO4 + 2NaOH → Na2SO4 + 2H2O
C. 6HCl + Fe2O3 → 2FeCl3 + 3H2O
D. Ca(OH)2 + CO2 → CaCO3 + H2O
Câu 8: Có 100 ml dung dịch Ba(OH)2 1M, thêm vào 100ml H2O thu được dung dịch X. Nồng độ OH – trong dung dịch X là:
A. 1M B. 2M C. 0,5M D. 1,5M
Câu 9: Cho 2 dung dịch HCl và CH3COOH có cùng nồng độ CM, Hãy so sánh độ pH của 2 dung dịch ?
A. Không so sánh được. B. HCl > CH3COOH.
C. HCl < CH3COOH. D. HCl = CH3COOH.
Câu 10: Các ion nào sau đây không cùng tồn tại trong một dung dịch:
A. NH4+, OH–, Fe3+, Cl– . B. Fe3+, NO3–, Mg2+, Cl–
C. Na+, NO3–, Mg2+, Cl– . D. H+, NH4+, SO42–, Cl–
Câu 11: Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ có thể xảy ra khi :
A. tạo thành chất kết tủa. B. tạo thành chất điện li yếu.
C. tạo thành chất khí. D. có ít nhất một trong 3 điều kiện trên.
Câu 12: Cho các muối sau: NaHSO4 , NaHCO3 , Na2HPO3 . Muối axit trong số đó là:
A. cả 3 muối B. NaHSO4, NaHCO3 C. Na2HPO3 D. NaHSO4
Câu 13: Cho các chất sau: HCl, H2S, HNO3, NaOH, Ca(OH)2, Al(OH)3, NaCl, BaCl2. Có bao nhiêu chất điện li yếu?
A. 3 B. 5 C. 4 D. 2
Câu 14: Phản ứng nào dưới đây là phản ứng trao đổi ion trong dd ?
A. Zn + H2SO4 → ZnSO4 + H2
B. Zn + 2Fe(NO3)3 → Zn(NO3)2 + 2Fe(NO3)2
C. Fe(NO3)3 + 3NaOH → Fe(OH)3 + 3NaNO3
D. 2Fe(NO3)3 + 2KI → 2Fe(NO3)2 + I2 + 2KNO3
Câu 15: Dung dịch H2SO4 có pH = 2 thì nồng độ của H2SO4 là :
A. 0,01M B. 0,05M C. 0,005M D. 0,1M
---Để xem tiếp nội dung từ câu 16-30 của Đề thi số 3, các em vui lòng xem online hoặc tải về máy tính--
2.4. Đề thi giữa HK1 môn Hóa học 11 – Số 4
TRƯỜNG THPT HÀ HUY TẬP
ĐỀ THI GIỮA HK1
NĂM HỌC: 2021-2022
MÔN: HÓA HỌC 11
Thời gian: 45 phút (không kể thời gian giao đề)
I. TRẮC NGHIỆM
Câu 1: Dãy chất nào sau đây, trong nước đều là chất điện li mạnh ?
A. H2SO4, Cu(NO3)2, CaCl2, NH3.
B. HCl, H3PO4, Fe(NO3)3, NaOH.
C. HNO3, CH3COOH, BaCl2, KOH.
D. H2SO4, MgCl2, Al2(SO4)3, Ba(OH)2.
Câu 2: Trong dung dịch H3PO4 (bỏ qua sự phân li của H2O) chứa bao nhiêu loại ion ?
A. 2.
B. 3.
C. 4.
D. 5.
Câu 3: Dung dịch A chứa các ion: Fe2+ (0,1 mol), Al3+ (0,2 mol), Cl- (x mol), SO42- (y mol). Cô cạn dung dịch A thu được 46,9g muối rắn. Giá trị của x và y lần lượt là
A. 0,1 và 0,35.
B. 0,3 và 0,2.
C. 0,2 và 0,3.
D. 0,4 và 0,2.
Câu 4: Dung dịch E chứa các ion Mg2+, SO42-, NH4+, Cl-. Chia dung dịch E ra 2 phần bằng nhau:
+ Phần I tác dụng với dung dịch NaOH dư, đun nóng, được 0,58 gam kết tủa và 0,672 lit khí (đktc).
+ Phần II tác dụng với dung dịch BaCl2 dư, được 4,66 gam kết tủa.
Tổng khối lượng các chất tan trong dung dịch E bằng
A. 6,11g.
B. 3,055g.
C. 5,35g.
D. 9,165g.
Câu 5. Các ion nào sau không thể cùng tồn tại trong một dung dịch?
A. Na+, Mg2+, NO , SO
B. Ba2+, Al3+, Cl–, HSO.
C. Cu2+, Fe3+, SO, Cl–
D. K+, NH, SO42–, PO
Câu 6: Trong các cặp chất cho dưới đây, cặp chất nào có thể cùng tồn tại trong một dung dịch?
A. AlCl3 và CuSO4.
B. NH3 và AgNO3 .
C. Na2ZnO2 và HCl.
D. NaHSO4 và NaHCO3
Câu 7: Một hỗn hợp rắn X có a mol NaOH; b mol Na2CO3; c mol NaHCO3. Hoà tan X vào nước sau đó cho tác dụng với dung dịch BaCl2 dư ở nhiệt độ thường. Loại bỏ kết tủa, đun nóng phần nước lọc thấy có kết tủa nữa. Vậy có kết luận là
A. a = b = c.
B. a > c.
C. b > c.
D. a < c.
Câu 8. Phương trình ion thu gọn: Ca2+ + CO32- → CaCO3 là của phản ứng xảy ra giữa cặp chất nào sau đây
1. CaCl2 + Na2CO3
2.Ca(OH)2 + CO2
3.Ca(HCO3)2 + NaOH
4. Ca(NO3)2 + (NH4)2CO3
A. 1 và 2.
B. 2 và 3.
C. 1 và 4.
D. 2 và 4.
Câu 9: Hỗn hợp A gồm Na2O, NH4Cl, NaHCO3, BaCl2 (có cùng số mol). Cho hỗn hợp A vào nước dư, đun nóng sau các phản ứng xảy ra hoàn toàn thu được dung dịch chứa:
A. NaCl, NaOH.
B. NaCl, NaOH, BaCl2 .
C. NaCl.
D. NaCl, NaHCO3, BaCl2.
Câu 10: Dãy các chất đều tác dụng với dung dịch Ca(OH)2 là:
A. Ba(NO3)2, Mg(NO3)2, HCl, CO2, Na2CO3
B. Mg(NO3)2, HCl, BaCO3, NaHCO3, Na2CO3 .
C. NaHCO3, Na2CO3, CO2, Mg(NO3)2, Ba(NO3)2
D. NaHCO3, Na2CO3, CO2, Mg(NO3)2, HCl.
-----Còn tiếp-----
2.5. Đề thi giữa HK1 môn Hóa học 11 – Số 5
TRƯỜNG THPT HUỲNH THÚC KHÁNG
ĐỀ THI GIỮA HK1
NĂM HỌC: 2021-2022
MÔN: HÓA HỌC 11
Thời gian: 45 phút (không kể thời gian giao đề)
Phần I: Trắc nghiệm: 2,5 điểm
Câu 1: Cho dãy các chất sau: HCl, H2SO4, H3PO4, NaOH, C2H5OH, Ba(OH)2, Fe(NO3)3, NH4Cl, KAlO2. Số chất điện li mạnh là:
A. 6
B. 7
C. 8
D. 9
Câu 2: Cho các chất sau: KOH, Ca(OH)2, Al(OH)3, Zn(OH)2, Sn(OH)2 và Pb(OH)2. Số chất có tính chất lưỡng tính là:
A. 2.
B. 3
C. 4
D. 5
Câu 3: Khi trộn 100 ml dung dịch Ba(OH)2 0,125M với 400 ml dung dịch HCl 0,05M thu được dung dịch có pH là:
A. 2
B. 6
C. 10
D. 12
Câu 4: Dãy gồm các ion có thể cùng tồn tại trong một dung dịch là:
A. NH4+, NO3-, HCO3-, OH-
B. K+, H+, SO42-, OH-
C. Na+, NH4+, H+,CO3 2-
D. Ca2+, Fe2+, NO3-, Cl-
Câu 5: Thể tích dung dịch HNO3 0,3M vừa đủ để trung hòa 100 ml dung dịch chứa hỗn hp NaOH 0,1M và Ba(OH)2 0,1M là
A. 100 ml
B. 150ml
C. 200 ml
D. 250 ml
Câu 6: Cho phản ứng hóa học NaOH + HCl → NaCl + H2O. Phản ứng hóa học nào sau đây có cùng phương trình ion rút gọn với phản ứng trên?
A. 2KOH + FeCl2 → Fe(OH)2 + 2KCl
B. NaOH + NaHCO3 → Na2CO3 + H2O
C. NaOH + NH4Cl → NaCl + NH3 + H2O
D. KOH + HNO3 → KNO3 + H2O
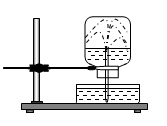
Câu 7: Cho thí nghiệm như hình vẽ, bên trong bình có chứa khí NH3, trong chậu thủy tinh chứa nước có nhỏ vài giọt phenolphthalein. Hiện tượng xảy ra trong thí nghiệm là:
A. Nước phun vào bình và chuyển thành màu xanh.
B. Nước phun vào bình và chuyển thành màu hồng.
C. Nước phun vào bình và không có màu.
D. Nước phun vào bình và chuyển thành màu tím.
Câu 8: Hòa tan hoàn toàn 13 gam Zn trong dung dịch HNO3 loãng, dư thu được dung dịch X và 0,448 lít khí N2 (đktc). Khối lượng muối trong dung dịch X là:
A. 37,8 gam
B. 18,9 gam
C. 28,35 gam
D. 39,8 gam
Câu 9: Dung dịch X gồm a mol Na+; 0,15 mol K+; 0,1 mol HCO3-; 0,15 mol CO32- và 0,05 mol SO42-. Tổng khối lượng muối trong dung dịch X là:
A. 33,8 gam
B. 28,5 gam
C. 29,5 gam
D. 31,3 gam
Câu 10: Cho 3,2 gam Cu tác dụng với 100 ml dung dịch gồm HNO3 0,8M và H2SO4 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, sinh ra V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là:
A. 0,448
B. 0,792
C. 0,672
D. 0,746
-----Còn tiếp-----
2.6. Đề thi giữa HK1 môn Hóa học 11 – Số 6
TRƯỜNG THPT PHAN ĐÌNH PHÙNG
ĐỀ THI GIỮA HK1
NĂM HỌC: 2021-2022
MÔN: HÓA HỌC 11
Thời gian: 45 phút (không kể thời gian giao đề)
PHẦN I: TRẮC NGHIỆM
Câu 1: Hòa tan hoàn toàn 1,2 gam kim loại X vào dung dịch HNO3 dư thu được 0,224 lít khí N2 ở đktc (sản phẩm khử duy nhất). Kim loại X là
A. Al B. Mg C. Zn D. Cu
Câu 2: Hai chất nào sau đây là đồng đẳng của nhau?
A. C2H5OH, CH3OCH3. B. CH3CH2CH2OH, C2H5OH.
C. CH3OCH3, CH3CHO. D. C4H10, C6H6.
Câu 3: Trong phòng thí nghiệm có thể điều chế N2 bằng cách
A. phân hủy khí NH3. B. nhiệt phân NaNO2.
C. thủy phân Mg3N2. D. Đun hỗn hợp NaNO2 và NH4Cl.
Câu 4: Công thức đơn giản nhất là công thức
A. biểu diễn số lượng nguyên tử của các nguyên tố trong phân tử
B. biểu thị tỉ lệ tối giản các nguyên tử của các nguyên tố trong phân tử
C. biểu thị tỉ lệ tối đa các nguyên tử của các nguyên tố trong phân tử
D. biểu thị tỉ lệ số nguyên tử của các nguyên tố trong phân tử
Câu 5: Cho 44g NaOH vào dung dịch chứa 39,2g H3PO4. Sau khi phản ứng xảy ra hoàn toàn. Hỏi những muối nào thu được và khối lượng muối khan thu được là bao nhiêu ?
A. Na2HPO4 và 14,2g ; Na3PO4 và 49,2g B. Na3PO4 và 50,0g
C. NaH2PO4 và 49,2g ; Na2HPO4 và 14,2g D. Na2HPO4 và 15,0g
Câu 6: Tìm phản ứng nhiệt phân sai:
A. 2AgNO3 → Ag2O + 2NO2 + 1/2O2 B. KNO3 → KNO2 + 1/2O2
C. Zn(NO3)2 → ZnO + 2NO2 + 1/2O2 D. Mg(NO3)2 → MgO + 2NO2 + 1/2O2
Câu 7: Theo thuyết cấu tạo hoá học, trong phân tử các chất hữu cơ, các nguyên tử liên kết hoá học với nhau theo cách nào sau đây:
A. đúng hoá trị. B. đúng số oxi hoá.
C. một thứ tự nhất định. D. đúng hoá trị và theo một thứ tự nhất định
Câu 8: Khí N2 tương đối trơ ở nhiệt độ thường là do
A. Trong phân tử N2 chứa liên kết 3 rất bền.
B. Nguyên tử nitơ có độ âm điện lớn nhất trong nhóm nitơ.
C. Nitơ có bán kính nguyên tử nhỏ, phân tử không phân cực.
D. Trong phân tử N2, mỗi nguyên tử còn một cặp electron chưa tham gia liên kết.
Câu 9: Ion NH4+ có tên gọi:
A. Cation nitric
B. Cation amino
C. Cation amoni
D. Cation hidroxyl
Câu 10: Cho 2,24 lít CO2 (đktc) vào 200 ml dung dịch Ca(OH)2 1M , khối lượng kết tủa thu được là
A. 10 g
B. 15 g
C. 20 g
D. 25 g
-----Còn tiếp-----
2.7. Đề thi giữa HK1 môn Hóa 11 số 7
Trường: THPT Phan Chu Trinh
Số câu: 40 câu trắc nghiệm
Thời gian làm bài: 45 phút
Năm học: 2021-2022
2.8. Đề thi giữa HK1 môn Hóa 11 số 8
Trường: THPT Trần Hưng Đạo
Số câu: 30 câu trắc nghiệm
Thời gian làm bài: 45 phút
Năm học: 2021-2022
2.9. Đề thi giữa HK1 môn Hóa 11 số 9
Trường: THPT Võ Thị Sáu
Số câu: 30 câu trắc nghiệm
Thời gian làm bài: 45 phút
Năm học: 2021-2022
2.10. Đề thi giữa HK1 môn Hóa 11 số 10
Trường: THPT Châu Thành
Số câu: 18 câu trắc nghiệm, 3 câu tự luận
Thời gian làm bài: 45 phút
Năm học: 2021-2022
...
---Bấm TẢI VỀ hoặc XEM ONLINE để xem đầy đủ nội dung các Đề thi 1-10---



