Hóa học 12 Bài 28: Luyện tập Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
Nội dung bài luyện tập Tính chất của Tính chất của kim loại kiềm, kim loại kiềm thổ là bài tổng ôn, củng cố các kiến thức đã học về Tính chất của kim loại kiềm, kim loại kiềm thổ. Ngoài ra còn rèn luyện cho các em học sinh kĩ năng giải các bài tập và các dạng toán quan trọng.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Vị trí của kim loại kiềm, kiềm thổ trong Bảng hệ thống tuần hoàn và cấu hình electron
- Kim loại kiềm:
+ Vị trí trong bảng tuần hoàn: nhóm IA
+ Cấu hình electron lớp ngoài cùng: ns1
+ Tính chất hóa học đặc trưng: Có tính khử mạnh nhất trong các kim loại
M → M+ + e
+ Điều chế: Điện phân muối halogen nóng chảy
2MX (đpnc) → 2M + X2
- Kim loại kiềm thổ:
+ Vị trí trong bảng tuần hoàn: nhóm IIA
+ Cấu hình electron lớp ngoài cùng: ns2
+ Tính chất hóa học đặc trưng: Có tính khử mạnh chỉ sau kim loại kiềm
M → M2+ + 2e
+ Điều chế: MX2 (đpnc) → M + X2
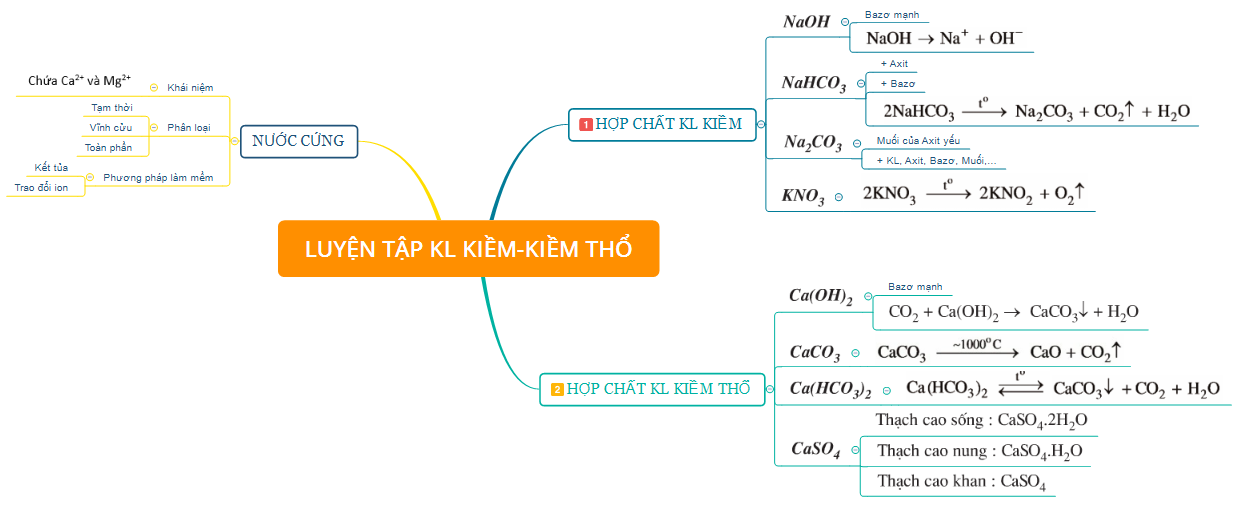
1.2. Một số hợp chất quan trọng của kim loại kiềm, kiềm thổ và Nước cứng
2. Bài tập minh họa
2.1. Dạng 1: Nước cứng và làm mềm nước cứng
Bài 1: Phát biểu nào sau đây đúng?
A. Nước cứng là nước có chứa các muối CaCl2, MgCl2,…
B. Nước mềm là nước có chứa ít hoặc không chứa các ion Ca2+, Mg2+
C. Nước trong tự nhiên đều là nước cứng vì có chứa cation Ca2+, Mg2+
D. Nước khoáng đều là nước cứng
Hướng dẫn giải
Nước chứa nhiều ion Ca2+ và Mg2+ được gọi là nước cứng
Phân loại:
- Nước có tính cứng tạm thời: Ca(HCO3)2 và Mg(HCO3)2
- Nước có tính cứng vĩnh cửu: muối SO42-, Cl-của Ca2+ và Mg2+
- Nước có tính cứng toàn phần : tạm thời + vĩnh cửu
→ Đáp án B
2.2. Dạng 2: Hỗn hợp kim loại kiềm, kiềm thổ, nhôm tác dụng với nước
Phương pháp
Cho kim loại kiềm, kiềm thổ vào nước thu được dung dịch chứa ion H+
Phương trình phản ứng
M + H2O → M+ + OH- + 1/2 H2
M + 2H2O → M2+ + 2OH- + H2
Nhận thấy: n2OH- = 2nH2
Nếu có kim loại Al thì OH- tác dụng với Al
Al + H2O + OH- → AlO2- + 3/2H2
Bài 1: Cho 2,22 gam hỗn hợp kim loại gồm K, Na và Ba vào nước được 500ml dung dịch X có pH = 13. Cô cạn dung dịch X được m gam chất rắn . m là:
A. 4,02
B. 3,42
C. 3,07
D. 3,05
Hướng dẫn giải
Ta có pH = 13 ⇒ pOH = 14 – 13 =1
⇒ [OH-] = 0,1M ⇒ nOH- = 0,1 . 0,5 = 0,05 mol
Áp dụng định luật bảo toàn khối lượng:
Ta có: m(bazơ) = m(kim loại) + mOH- = 2,22 + 0,05 .17 = 3,07 g
→ Đáp án C
Bài 2: Chia hỗn hợp X gồm K, Al, Fe thành 2 phần bằng nhau:
- Cho phần 1 vào dung dich KOH dư thu được 0,784 lít khí H2 (đktc).
- Cho phần 2 vào một lượng H2O dư thu được 0,448 lít khí H2 (đktc) và m gam hỗn hợp kim loại Y. Hòa tan hoàn toàn Y vào dung dịch HCl dư thu được 0,56 lít khí H2 (đktc).
Khối lượng tính theo gam cả K, Al, Fe trong mỗi phần hỗn hợp X lần lượt là:
A. 0,39; 0,54; 1,40
B. 0,78; 0,54; 1,12
C. 0,39; 0,54; 0,56
D. 0,78; 1,08; 0,56
Hướng dẫn giải
Ta thấy lượng H2 sinh ra khi tác dụng với H2O ít hơn so với lượng H2 khi tác dụng với KOH ⇒ Khi tác dụng với H2O, Al còn dư
Gọi số mol K, Al, Fe trong mỗi hợp lần lượt là: x, y, z (mol)
nH2 = 2x = 0,02 ⇒ x = 0,01, thay vào (1) ⇒ y = 0,02
Hỗn hợp Y gồm Al dư và Fe phản ứng với HCl
nAl dư = y – x = 0,01 mol
nH2 = 1,5nAl dư + nFe = 0,025 ⇒ z = 0,01
Vậy mK = 0,39g; mAl = 0,54g; mFe = 0,56g
→ Đáp án C
2.3. Dạng 3: Bài toán về tính lưỡng tính của nhôm, hợp chất của nhôm
Phương pháp
- Al, Al2O3, Al(OH)3 ngoài tác dụng với axit còn có khả năng phản ứng với dung dịch kiềm.
- Khi cho muối Al3+ tác dụng với dung dịch kiềm, tùy theo tỉ lệ mol mà phản ứng xảy ra theo thứ tự:
Al3+ + 3OH- → Al(OH)3 (1)
Nếu OH- dư tiếp tục xảy ra phản ứng:
Al(OH)3 + OH- → AlO2- + H2O (2)
- Dung dịch muối có khả năng tác dụng với axit tạo kết tủa:
AlO2- + H+ + H2O → Al(OH)3
Các dạng bài thường gặp:
- Nếu tính được tỉ lệ = T
+ T ≤ 3 ⇒ Al3+ dư ⇒ chỉ xảy ra phản ứng (1) và tạo kết tủa nOH- = 3n↓
+ T ≥ 4⇒ OH- dư sau phản ứng (1) và đủ hoặc dư phản ứng (2) do đó kết tủa bị hòa tan hết, không tạo kết tủa
+ 3 < T < 4 ⇒ Xảy ra cả phản ứng (1) và (2): Kết tủa tạo ra ở phản ứng (1) và bị tan 1 phần ở phản ứng (2) nOH- = 4nAl3+ - n↓
- Nếu bài toán cho n↓ và nAl3+
+ n↓ = nAl3+ ⇒ Chỉ xảy ra phản ứng (1)
+ n↓ ≠ nAl3+
TH1: Al3+ dư, chỉ xảy ra phản ứng (1) ⇒ nOH- = 3n↓
TH2: OH- dư sau phản ứng (1) ⇒ xảy ra phản ứng (2) và kết tủa bị hòa ton 1 phần
- Khi cho từ từ OH- vào dung dịch Al3+, dựa vào số liệu và hiện tượng để xét các trường hợp trên để giải toán
Chú ý:
+ Lượng OH- lớn nhất khi OH- dư và hòa tan kết tủa:
nOH- = 4nAl3+ - n↓
+ Lượng kết tủa lớn nhất khi kết tủa sinh ra chưa bị hòa tan:
n↓ = nAl3+
+ Khi cho từ từ H+ ( hoặc sục khí CO2) vào dung dịch chứa AlO2- ( hay Al(OH)4-) thì các phản ứng xảy ra theo thứ tự
AlO2- + H+ + H2O → Al(OH)3 (3)
Sau đó H+ dư xảy ra phản ứng:
Al(OH)3 + 3H+ → Al3+ + 3H2O (4)
Tùy vào tỉ lệ số mol của AlO2- và H+ mà có thể kết tủa lại hoặc tạo kết tủa và kết tủa tan
+ Nếu AlO2- dư ⇒ Chỉ xảy ra phản ứng (3)
nH+ = n↓
+ Nếu H+ dư, tạo kết tủa rồi kết tủa lại tan một phần ⇒ Xảy ra cả phản ứng (3) và (4)
nH+ = 4nAlO2- - 3n↓
Bài 1: Cho V (lít) dung dịch Ba(OH)2 0,5M vào 200ml dung dịch Al(NO3)3 0,75M thu được 7,8g kết tủa. Vậy giá trị của V là:
A. 0,3 và 0,6
B. 0,3 và 0,7
C. 0,4 và 0,8
D. 0,3 và 0,5
Hướng dẫn giải
n↓ = nAl(OH)3 = 7,8/78 = 0,1 mol
nAl3+ = 0,75.0,2 = 0,15 ≠ n↓
⇒ TH2: Al3+ dư ; nOH- = 3n↓ = 0,3⇒ nBa(OH)2 = 0,15⇒ V = 0,3
⇒ TH2: OH- dư hòa tan một phần kết tủa
nOH- = 4nAl3+ - n↓ = 0,5 ⇒ nBa(OH)2 = 0,25 ⇒ V = 0,5
→ Đáp án D
Bài 2: Cho từ từ 0,7 mol NaOH vào dung dịch chứa 0,1 mol Al2(SO4)3. Số mol kết tủa thu được là:
A. 0,2
B. 0,15
C. 0,1
D. 0,05
Hướng dẫn giải
nAl3+ = 0,2
nOH- : nAl3+ = 0,7 : 0,2 = 3,5
⇒ Tạo kết tủa Al(OH)3 và kết tủa tan một phần
nOH- = 4nAl3+ - n↓ ⇒ n↓ = 4.0,2 – 0,7 = 0,1 mol
→ Đáp án C
2.4. Dạng 4: Bài toán CO2, SO2 tác dụng với dung dịch bazơ
Phương pháp
OH- + CO2 → CO32- + H2O (1)
OH- + CO2 → HCO3- (2)
Lập tỉ số: K = nCO2 : nNaOH
Nếu : K ≥ 2: Chỉ tạo muối cacbonat (CO32-), chỉ xảy ta phản ứng (1)
K ≤ 1: Chỉ tạo axit (HCO3-), chỉ xảy ra phản ứng (2)
1 < K < 2: tạo ra hỗn hợp muối ( HCO3- và CO32-) xảy ra cả 2 phản ứng (1) và (2)
Lưu ý: Với những bài toàn không tính được K, ta phải dựa vào dữ kiện đề bài để tìm ra khả năng tạo muối như:
+ Hấp thu CO2 vào chỉ dung dịch bazơ dư ⇒ chỉ tạo muối CO32-
+ Hấp thu CO2 dư vào chỉ dung dịch bazơ ⇒ chỉ tạo muối HCO3-
+ Nếu dung dịch sau phản ứng thêm OH- vào lại sinh ra CO32- ( hoặc đun nóng ) ⇒ Trong dung dịch có HCO3-:
HCO3- + OH- → CO32-
HCO3- → CO32- + CO2 + H2O
+ Nếu bài toán không cho bất kì dữ liệu nào thì phải chia trường hợp để giải
Bài 1: Hấp thụ hoàn toàn 4,48l khí CO2 ở (đktc) vào 500ml dung dịch hỗn hợp gồm NaOH 0,1M và Ba(OH)2 0,2M, sinh ra m gam kết tủa. Gía trị của m là:
A. 19,70
B. 17,73
C. 9,85
D. 11,82
Hướng dẫn giải
nCO2 = 0,2 mol; nOH- = nNaOH + 2nBa(OH)2 = 0,25 mol
1 < nOH- : nCO2 < 2 ⇒ Tạo hỗn hợp muối CO32- và HCO3-
CO2 + OH- → HCO3- (1)
x x x
CO2 + 2OH- → CO32- (2)
y 2y y
nCO2 = x + y = 0,2
nOH- = x + 2y = 0,25
⇒ x = 0,15; y = 0,05
Ba2+ + CO32- → BaCO3
0,1 0,05
⇒ nBa2+ = nCO32- = 0,05 ⇒ m = 0,05 .197 = 9,85g
→ Đáp án C
Bài 2: Sục a mol khí CO2 vào dung dịch Ca(OH)2 thu được 3g kết tủa. Lọc tách kết tủa rồi đun nóng nước lọc lại thu được thêm 2g kết tủa nữa. Gía trị của a là:
A. 0,05 mol
B. 0,06 mol
C. 0,07 mol
D. 0,08 mol
Hướng dẫn giải
nCaCO3 lúc đầu = 0,03 mol
Đun thêm nước lọc lại thu được kết tủa → trong dung dịch có muối HCO3-
nCaCO3 thêm = nCO32- = 0,02
2HCO3- → CO32- + CO2 + H2O
0,04 0,02
Bảo toàn C: nCO2 = nCaCO3 lúc đầu + nHCO3- = 0,03 + 0,04 = 0,07 mol
→ Đáp án C
2.5. Dạng 5: Bài toán về muối cacbonat
Phương pháp
Với muối cacbonat ta thường gặp hai dạng bài:
- Phản ứng nhiệt phân:
2HCO3- → CO32- + CO2 + H2O
M(CO3)2 → MO + CO2
- Phản ứng trao đổi (với axit → khí; với muối → kết tủa)
Chú ý :
- Khi cho từ từ HCl vào hỗn hợp muối cacbonat và hiđrocacbonat phản ứng xảy ra theo trình tự:
Đầu tiên: H+ + CO32- → HCO3-
Sau đó: H+ + HCO3- → CO2 + H2O
- Khi cho từ từ hỗn hợp muối cacbonat và hiđrocacbonat vào dung dịch HCl, xảy ra đồng thời theo đúng tỉ lệ của 2 muối để tạo khí CO2
Bài 1: Nhỏ từ từ từng giọt đến hết 30ml dung dịch HCl 1M vào 100ml dung dịch chưa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là:
A. 0,03
B. 0,01
C. 0,02
D. 0,015
Hướng dẫn giải
nHCl = 0,03 mol; nNa2CO3 = 0,02 mol; nNaHCO3 = 0,02 mol
Khi cho từ từ HCl vào dung dịch xảy ra phản ứng theo thứ tự:
H+ + CO32- → HCO3-
0,02 0,02 0,02 (mol)
nH+ còn = 0,01 mol; nHCO32- = 0,02 + 0,02 = 0,04 mol
H+ + HCO3- → CO2 + H2O
0,01 0,04
⇒ nCO2 = nH+ = 0,01 mol
→ Đáp án B
Bài 2: Nhỏ từ từ 200ml dung dịch X (K2CO3 1M và NaHCO3 0,5M) vào 200ml dung dịch HCl 2M thì thể tích khí CO2 thu được là:
A. 4,48 lít
B. 5,376 lít
C. 8,96 lít
D. 4,48 lít
Hướng dẫn giải
nCO32- = 0,2 mol; nHCO3- = 0,1 mol; nH+ = 0,4 mol
nCO32- : nHCO3- = 2:1
⇒ 5H+ + 2CO32- + HCO3- → 3CO2 + 3H2O
0,4 0,2 0,1
⇒ H+ hết; nCO2 = 3/5 nH+ = 0,24 ⇒ VCO2 = 5,376 lít
→ Đáp án B
2.6. Dạng 6: Phản ứng nhiệt nhôm (Cho bột Al tác dụng với oxit kim loại)
Phương pháp
2yAl + 3MxOy → yAl2O3 + 3Xm
M là các kim loại có tính khử trung bình và yếu
Thường gặp: 2yAl + 3FexOy → yAl2O3 + 3xFe
Các trường hợp có thể xảy ra:
- Hiệu suất phản ứng H= 100% ( phản ứng xảy ra hoàn toàn) . Nếu cho sản phẩm tác dụng với dung dịch kiềm có H2 thoát ra, thì sản phẩm có Al dư, Fe và Al2O3
- Nếu H < 100% ( phản ứng không hoàn toàn). Khi đó hỗn hợp sau phản ứng gồm: Al, FexOy, Al2O3, Fe.
Bài 1: Nung hỗn hợp gồm 10,8g Al và 16,0g Fe2O3 (trong điều kiện không có không khí), sau khi phản ứng xảy ra hoàn toàn thu được chất rắn Y. Khối lượng kim loại trong Y là:
A. 5,6g
B. 22,4g
C. 11,2g
D. 16,6g
Hướng dẫn giải
nAl = 0,4; nFe2O3 = 0,1 mol
2Al + Fe2O3 → Al2O3 + 2Fe
⇒ nAl dư = 0,4 – 0,2 = 0,2 mol
⇒nFe = 2 nFe2O3 = 0,2
⇒mkl = mAl + mFe = 0,2.27 + 0,2.56 = 16,6g
→ Đáp án D
Bài 2: Đốt nóng một hỗn hợp gồm Al và Fe2O3 (trong điều kiện không có không khí). Nếu cho những chất sau phản ứng tác dụng với NaOH dư sẽ thu được 0,3mol H2; còn nếu cho tác dụng với dung dịch HCl dư sẽ thu được 0,4 mol H2. Vậy số mol Al trong hỗn hợp X là:
A. 0,3
B. 0,4
C. 0,25
D. 0,6
Hướng dẫn giải
Cho hỗn hợp sau phản ứng tác dụng với NaOH → H2
⇒ Trong hỗn hợp có Al dư; nAl = 2/3nH2 = 0,2 mol
Cho tác dụng với HCl: nH2 = 3/2 nAl + nFe⇒ nFe = 0,1 mol
Fe2O3 + 2Al → Al2O3 + 2Fe
0,1 ← 0,1 ( mol)
⇒ nAl = 0,2 + 0,1 = 0,3 mol
→ Đáp án A
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Hỗn hợp rắn A gồm Ca(HCO3); CaCO3; NaHCO3; Na2CO3. Nung A đến khối lượng không đổi được chất rắn B gồm?
Câu 2: Cho các chất: Na2CO3; NaHCO3; NaHSO4; HCl; BaCl2; CuO; Fe. Số cặp chất có thể tác dụng trực tiếp với nhau ở nhiệt độ thường là?
Câu 3: Hoà tan hoàn toàn 14,52 gam hỗn hợp X gồm NaHCO3, KHCO3 và MgCO3 bằng dd HCl dư, thu được 3,36 lít khí CO2 (đktc) và dd chứa m gam muối KCl. Giá trị của m là?
Câu 4: Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào dung dịch chứa 0,15 mol NaOH và 0,1 mol Ba(OH)2, thu được m gam kết tủa. Giá trị của m là?
Câu 5: Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 131,4 gam X vào nước, thu được 6,72 lít khí H2 (đktc) và dung dịch Y, trong đó có 123,12 gam Ba(OH)2. Hấp thụ hoàn toàn 40,32 lít khí CO2 (đktc) vào Y, thu được m gam kết tủa. Giá trị của m là?
3.2. Bài tập trắc nghiệm
Câu 1: Để bảo quản các kim loại kiềm, có thể thực hiện cách nào sau đây ?
A. Để trong lọ thủy tinh có không khí nhưng đậy nắp kín.
B. Ngâm trong ancol nguyên chất.
C. Để trong lọ thủy tinh có chất hút ẩm và đặt trong bóng tối.
D. Ngâm trong dầu hỏa.
Câu 2: Một loại nước cứng tạm thời chứa ion Ca2+. Cô cạn 100 ml dung dịch nước cứng này thu được 156,8 ml CO2 (đktc). Để loại bỏ tính cứng tạm thời của 1 lít nước cứng này cần dùng tối thiếu số ml dung dịch NaOH 0,1M là:
A 140 ml.
B. 700 ml.
C. 70 ml.
D. 1400 ml.
Câu 3: Cho 7,1 gam hỗn hợp gồm một kim loại kiềm X và một kim loại kiềm thổ Y tác dụng với lượng dư dung dịch HCl loãng thu được 5,6 lít khí. Hai kim loại X, Y có thể là:
A K và Ba
B. K và Ca.
C. Na và Mg.
D. Li và Be.
Câu 4: Hoà tan 46 gam một hỗn hợp Ba và hai kim loại kiềm A, B thuộc hai chu kì kế tiếp nhau vào nước thu được dung dịch C và 11,2 lít khí (đktc). Nếu thêm 0,18 mol Na2SO4 vào dung dịch C thì dung dịch sau phản ứng vẫn chưa kết tủa hết Ba. Nếu thêm 0,21 mol Na2SO4 vào dung dịch C thì dung dịch sau phản ứng còn dư Na2SO4. A và B là:
A. Li và Na.
B. Na và K.
C. K và Rb.
D. Rb và Cs.
Câu 5: Hòa tan hoàn toàn 8,94 gam hỗn hợp gồm Na, K và Ba vào nước thu được dung dịch X và 2,688 lit khí H2 (đktc) . Dung dịch Y gồm HCl và H2SO4 có tỉ lệ mol tương ứng: 4: 1. Trung hòa dung dịch X bởi dung dịch Y, tổng khối lượng các muối được tạo ra là:
A. 13,7
B. 12,78
C. 18,46
D. 14,62
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Luyện tập Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng Hóa học 12 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Tính chất của kim loại kiềm, kim loại kiềm thổ.
- Kĩ năng giải các bài tập và các dạng toán quan trọng.
Tham khảo thêm
- pdf Hóa học 12 Bài 25: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm
- docx Hóa học 12 Bài 26: Kim loại kiềm thổ và hợp chất quan trọng của chúng
- docx Hóa học 12 Bài 27: Nhôm và hợp chất của Nhôm
- docx Hóa học 12 Bài 29: Luyện tập Tính chất của nhôm và hợp chất của nhôm
- docx Hóa học 12 Bài 30: Thực hành Tính chất của natri, magie, nhôm và hợp chất của chúng



