Hóa học 12 Bài 37: Luyện tập Tính chất hóa học của sắt và hợp chất của sắt
Nội dung bài học chính là câu trả lời sâu sắc cho câu hỏi Vì sao Sắt thường có số oxi hóa +2, +3 và ôn tập lại các tính chất hóa học đặc trưng của hợp chất Sắt(II), Sắt (III). Đồng thời rèn luyện cho các em các kĩ năng giải bài tập về Sắt và các hợp chất của Sắt.
Mục lục nội dung
2.1. Dạng 1: Phương pháp điều chế
2.2. Dạng 2: Bài tập Fe tác dụng với phi kim
2.3. Dạng 3: Bài tập về tính OXH của muối Sắt (III)
2.4. Dạng 4: Bài tập hợp chất sắt td với axit
2.5. Dạng 5: Phương pháp quy đổi
2.6. Dạng 6: Bài toán sắt tác dụng với muối
2.7. Dạng 7: Bài toán sắt tác dụng với H2SO4 đ,n

1. Tóm tắt lý thuyết
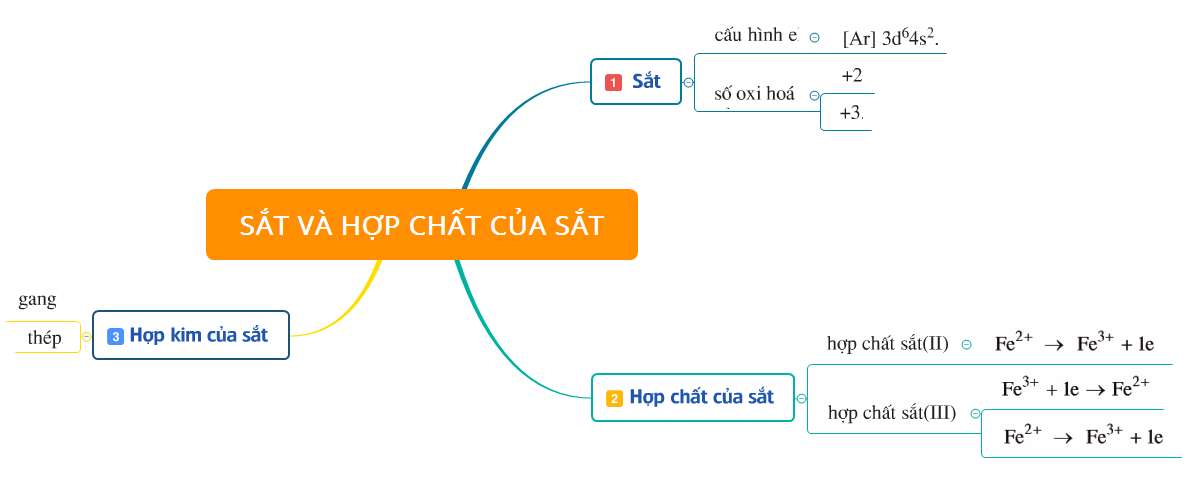
2. Bài tập minh họa
2.1. Dạng 1: Phương pháp điều chế Sắt (Fe) và hợp chất
Bài 1: Phản ứng nào sau đây không tạo ra FeSO4?
A. Cho Fe tác dụng với dung dịch H2SO4.
B. Cho Fe tác dụng với dung dịch Fe2(SO4)3.
C. Cho Cu tác dụng với dung dịch Fe2(SO4)3.
D. Cho Fe tác dụng với dung dịch H2SO4 đặc nóng.
Hướng dẫn giải
Chọn đáp án D
Giải thích: 2Fe + 6H2SO4 đặc → Fe2(SO4)3 + 3SO2 + 6H2O
Bài 2: Loại quặng nào sau đây không chứa sắt?
A. Quặng manhetit.
B. Quặng xiđerit và quặng pirit.
C. Quặng hematit đỏ và hematit nâu.
D. Quặng sinvinit.
Hướng dẫn giải
Trong tự nhiên, sắt tồn tại dưới dạng quặng:
+ Quặng hematit đỏ (chứa Fe2O3 khan)
+ Quặng hematit nâu (chứa Fe2O3.nH2O)
+ Quặng manhetit (chứa Fe3O4) là quặng giàu sắt nhất.
+ Quặng xiđerit chứa FeCO3
+ Quặng pirit chứa FeS2
→ Chọn đáp án D
Quặng sinvinit chứa KCl. NaCl
2.2. Dạng 2: Bài tập Sắt tác dụng với phi kim (Cl, O, S)
Cho a mol sắt tác dụng với 1,25a mol khí clo, thu được hỗn hợp chất rắn X. Cho X vào nước, thu được dung dịch Y. Biết các phản ứng xảy ra hoàn toàn. Các chất trong dd Y là:
A. FeCl2
B. FeCl2, FeCl3
C. FeCl2, Fe
D. FeCl3
Hướng dẫn giải
Chọn đáp án B
PTHH: 2Fe + 3Cl2 → 2FeCl3
a mol 1,25a mol
Ta có: a/2 > (1,25a)/3 => Fe dư
Chất rắn X chứa:
nFeCl3 = 2. (1,25a/3) = 5a/6 mol; nFe dư = a - (5a/6) = a/6 mol
Khi cho X vào nước xảy ra phản ứng:
Fe + 2FeCl3 → 3FeCl2
a/6 5a/6 mol
→ Sau phản ứng dung dịch Y có FeCl2 và FeCl3 dư.
2.3. Dạng 3: Bài tập về tính oxi hóa của muối Sắt (III)
Cho m gam Fe vào dung dịch X chứa 0,1 mol Fe(NO3)3 và 0,4 mol Cu(NO3)2. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y và m gam chất rắn Z. Giá trị của m là?
Hướng dẫn giải
Nhận thấy lượng chất rắn trước phản ứng và sau phản ứng không đổi → chứng tỏ lượng Cu bám vào bằng lượng Fe bị hoà tan
Phương trình phản ứng Fe + 2Fe3+ → 3Fe2+ và Fe + Cu2+ → Fe2+ + Cu
Gọi số mol Cu tạo thành là x mol → số mol Fe phản ứng là 0,05 + x
Chất rắn thu được gồm Fe và Cu
→ m - 56. (0,05 + x) + 64x = m → x = 0,35
→ m = 56. (0,35 +0,05) = 22,4 gam.
2.4. Dạng 4: Bài tập Hợp chất sắt tác dụng với axit
Hòa tan hoàn toàn 49,6 gam hỗn hợp X gồm Fe, FeO, Fe2O3, Fe3O4 bằng H2SO4 đặc nóng thu được dung dịch Y và 8,96 lít khí SO2 (đktc). Khối lượng muối trong dung dịch Y là
A. 160 gam.
B. 140 gam.
C. 120 gam.
D. 100 gam.
Hướng dẫn giải
Chọn đáp án B
Quy đổi hỗn hợp X thành Fe (a) và O (b)
→ mX = 56a + 16b = 49,6
Bảo toàn electron: 3a = 2b + 0,4. 2
→ a = 0,7 và b = 0,65
nFe2(SO4)3 = a/2 = 0,35 mol
→ mFe2(SO4)3 = 140g
2.5. Dạng 5: Phương pháp quy đổi để giải nhanh bài toán oxit sắt
Cho 9,12 gam hỗn hợp gồm FeO, Fe2O3, Fe3O4 tác dụng với dung dịch HCl dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y. Cô cạn dung dịch Y thu được 7,62 gam FeCl2 và m gam FeCl3. Giá trị của m là:
A. 9,75
B. 8,75
C. 7,80
D. 6,50
Hướng dẫn giải
Chọn đáp án A
Xem Fe3O4 là FeO.Fe2O3
Ta có: nFeCl2 = 7,62/127 = 0,06 (mol)
FeO + 2HCl → FeCl2 + H2O
0,06 0,06
⇒ nFe2O3 = (9,12 - 0,06. 72)/160 = 0,03 mol
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
0,03 0,06
⇒ mFeCl3 = 0,06. 162,5 = 9,75 (g)
2.6. Dạng 6: Bài toán sắt tác dụng với dung dịch muối
Ngâm 15 gam hỗn hợp Fe và Cu trong dung dịch CuSO4 dư. Phản ứng xong thu được 16 gam chất rắn. Thành phần phần trăm khối lượng của mỗi kim loại trong hỗn hợp ban đầu tương ứng là:
A. 53,34% và 46,66%
B. 46,67% và 53,33%
C. 40% và 60%
D. 60% và 40%
Hướng dẫn giải
Chọn đáp án B
Phương trình phản ứng:
Fe + CuSO4 → FeSO4 + Cu
(mol) a a
mtăng = (64 - 56). a = 1 → a = 0,125 mol
nFe = 0,125mol → nCu = (15-56.0,125)/64 = 0,125 mol
Thành phần phần trăm theo khối lượng:
%mFe = (0,125×56)/15. 100% = 46,67%
→ %mCu = 53,33%
2.7. Dạng 7: Bài toán sắt tác dụng với H2SO4 (axit sunfuric) đặc nóng
Hòa tan m (gam) Fe bằng dung dịch H2SO4 đặc nóng dư, thu được 1,344 lít khí SO2 (sản phẩm khử duy nhất đo ở đktc). Giá trị của m là
A. 3,36
B. 1,764
C. 2,24
D. 0,896
Hướng dẫn giải
Chọn đáp án C
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
(H2SO4 dư nên chỉ tạo muối Fe(III))
nSO2 = 0,06 mol
BTe → nFe = 2/3. nSO2 = 0,04 mol
→ mFe = 0,04. 56 = 2,24g
2.8. Dạng 8: Bài toán sắt tác dụng với HNO3 (axit nitric)
Hoà tan hoàn toàn 12 gam hỗn hợp Fe và Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít (đktc) hỗn hợp khí X (gồm NO và NO2) và dung dịch Y (chỉ chứa hai muối và axit dư). Tỉ khối của X đối với H2 bằng 19. Giá trị của V là.
A. 2,24
B. 5,60
C. 3,36
D. 4,48
Hướng dẫn giải
Như vậy đề bài cho axit dư nên 2 muối thu được là Fe3+ và Cu2+
Gọi x là số mol Fe và Cu ta có: 56x + 64x = 12 => x = 0,1 mol
Fe → Fe3+ + 3e
0,1 mol 0,3 mol
Cu → Cu2+ + 2e
0,1 mol 0,2 mol
Mặt khác: dX/H2 = 19 → MX = 38
Đặt x, y là số mol của NO và NO2 thì 30x + 46 y = 38 (x+ y) → x = y
ne nhận = 3x + y = 4x, ne cho = 0,5 → 4x = 0,5 . Vậy x = 0,125 mol
V = 0,125. 2. 22.4 = 5,6 lít
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Cho bột sắt đến dư vào 200 ml dung dịch HNO3 4M (phản ứng giải phóng khí NO), lọc bỏ phần rắn không tan thu được dung dịch X, cho dung dịch NaOH dư vào dung dịch X thu được kết tủa, lọc lấy kết tủa đem nung ngoài không khí ở nhiệt độ cao đến khối lượng không đổi thu được bao nhiêu gam chất rắn?
Câu 2: Khử hoàn toàn 16 gam Fe2O3 bằng khí CO ở nhiệt độ cao. Khí đi ra sau phản ứng được dẫn vào dung dịch Ca(OH)2 dư. Khối lượng kết tủa thu được là?
Câu 3: Nhỏ từ từ đến dư dung dịch NaOH vào dung dịch X chứa FeCl3 và AlCl3 thu được đồ thị sau. Giá trị n gần nhất với giá trị nào sau đây?
Câu 4: Trộn 8,1 gam Al với 35,2 gam hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 và Fe(NO3)2 thu được hỗn hợp Y. Hòa tan hoàn toàn Y vào dung dịch chứa 1,9 mol HCl và 0,15 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Z (không chứa muối amoni) và 0,275 mol hỗn hợp khí T gồm NO và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Z. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch M; 0,025 mol khí NO (sản phẩm khử duy nhất của N+5) và 280,75 gam kết tủa. Phần trăm khối lượng của Fe(NO3)2 trong Y là?
Câu 5: Hoà tan hoàn toàn một lượng hỗn hợp X gồm Fe3O4 và FeS2 trong 63 gam dung dịch HNO3 nồng độ a (%), thu được 1,568 lit NO2 (đktc) duy nhất và dung dịch Y. Dung dịch Y tác dụng vừa đủ với 200 ml dung dịch NaOH 2M, lọc kết tủa đem nung đến khối lượng không đổi, thu được 9,76 gam chất rắn. Giá trị của a là?
3.2. Bài tập trắc nghiệm
Câu 1: Nung Fe(NO3)2 trong bình kín, không có không khí, thu được sản phẩm gồm
A. FeO, NO.
B. Fe2O3, NO2 và O2.
C. FeO, NO2 và O2.
D. FeO, NO và O2.
Câu 2: Muối sắt được dùng làm chất diệt sâu bọ có hại cho thực vật là
A. FeCl3.
B. FeCl2.
C. FeSO4.
D. (NH4)SO4.Fe2(SO4)3.24H2O.
Câu 3: Hòa tan một oxit sắt vào dung dịch H2SO4 loãng dư được dung dịch X.
Chia dung dịch X làm 2 phần bằng nhau:
- Phần 1: Cho một ít vụn Cu vào thấy tan ra và cho dung dịch có màu xanh
- Phần 2: Cho một vài giọt dung dịch KMnO4 vào thấy bị mất màu.
Oxit sắt là
A. FeO.
B. Fe3O4.
C. Fe2O3.
D. FeO hoặc Fe2O3.
Câu 4: Hòa tan Fe3O4 vào dung dịch HCl được dung dịch X. Chia X làm 3 phần:
- Thêm NaOH dư vào phần 1 được kết tủa Y. Lấy Y để ngoài không khí.
- Cho bột Cu vào phần 2.
- Sục Cl2 vào phần 3.
Trong các quá trình trên có số phản ứng oxi hoá - khử là
A. 2.
B. 3.
C. 4.
D. 5.
Câu 5: Khi điều chế FeCl2 bằng cách cho Fe tác dụng với dung dịch HCl. Để bảo quản dung dịch FeCl2 thu được không bị chuyển thành hợp chất sắt (III), người ta có thể cho thêm vào dung dịch
A. một lượng sắt dư.
B. một lượng kẽm dư.
C. một lượng HCl dư.
D. một lượng HNO3 dư.
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Luyện tập Tính chất hóa học của sắt và hợp chất của sắt Hóa học 12 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Vì sao Sắt thường có số oxi hóa +2, +3 và ôn tập lại các tính chất hóa học đặc trưng của hợp chất Sắt(II), Sắt (III).
- Nghiên cứu một số hiện tượng đời sống cơ bản
Tham khảo thêm
- docx Hoá học 12 Bài 31: Sắt
- pdf Hóa học 12 Bài 32: Hợp chất của sắt
- pdf Hoá học 12 Bài 33: Hợp kim của sắt
- docx Hóa học 12 Bài 34: Crom và hợp chất của Crom
- docx Hóa học 12 Bài 35: Đồng và hợp chất của Đồng
- docx Hóa học 12 Bài 36: Sơ lược về Niken, Kẽm, Chì, Thiếc
- docx Hoá học 12 Bài 38: Luyện tập Tính chất hóa học của crom, đồng và hợp chất của chúng
- docx Hoá học 12 Bài 39: Thực hành Tính chất hóa học của sắt, đồng và hợp chất của sắt, crom



