Giải bài tập SBT Hóa 11 Bài 16: Hợp chất của cacbon
Mời các em cùng tham khảo nội dung giải bài tập Hợp chất của cacbon được eLib sưu tầm và biên soạn bên dưới đây. Đây là tài liệu tham khảo hay dành cho quý thầy cô cùng các bạn học sinh lớp 11 nhằm phục vụ quá trình giảng dạy và học tập môn Hóa học lớp 11.
Mục lục nội dung

1. Giải bài 3.6 trang 22 SBT Hóa học 11
Hoàn thành các phương trình hoá học sau đây (ghi rõ số oxi hoá của cacbon):
(1) CO + O2 to→ ?
(2) CO + Cl2 to, xt→ ?
(3) CO + CuO to→ ? + ?
(4) CO + Fe3O4 to→ ? + ?
(5) CO + I2O5 to→ I2 + ?
Trong các phản ứng này CO thể hiện tính chất gì ?
Phương pháp giải
Xem lại lí thuyết về hợp chất của Cacbon để điền chất thích hợp vào dấu "?"
Dựa vào số oxi hóa trước và sau phản ứng của nguyên tố C để kết luận CO thể hiện tính gì.
Nếu số oxi hóa tăng → CO thể hiện tính khử.
Nếu số oxi hóa giảm → CO thể hiện tính oxi hóa.
Hướng dẫn giải
\(\begin{gathered} 1.\,\mathop C\limits^{ + 2} O + {O_2}\xrightarrow{{{t^0}}}2\mathop C\limits^{ + 4} {O_2} \hfill \\ 2.\,\mathop C\limits^{ + 2} O + C{l_2}\xrightarrow{{{t^0},xt}}\mathop C\limits^{ + 4} OC{l_2} \hfill \\ 3.\,\mathop C\limits^{ + 2} O + CuO\xrightarrow{{{t^0}}}Cu + \mathop C\limits^{ + 4} {O_2} \hfill \\4.\,4\mathop C\limits^{ + 2} O + F{e_3}{O_4}\xrightarrow{{{t^0}}}3Fe + 4\mathop C\limits^{ + 4} {O_2} \hfill \\5.\,\mathop C\limits^{ + 2} O + {I_2}{O_5}\xrightarrow{{{t^0}}}{I_2} + 5\mathop C\limits^{ + 4} {O_2} \hfill \\\end{gathered}\)
2. Giải bài 3.7 trang 23 SBT Hóa học 11
Hoàn thành các phương trình hoá học sau?
(1) CO2 + Mg to→
(2) CO2 + CaO →
(3) CO2 (dư) + Ba(OH)2 →
(4) CO2 + H2O ↔
(5) CO2 + CaCO3 + H2O ↔
(6) CO2 + H2O as, diệp lục→
Phương pháp giải
Xem lại lí thuyết về hợp chất của Cacbon để tìm chất thích hợp.
Hướng dẫn giải
(1) CO2 + Mg to→ 2MgO + C
(2) CO2 + CaO → CaCO3
(3) CO2 (dư) + Ba(OH)2 → Ba(HCO3)2
(4) CO2 + H2O ↔ H2CO3
(5) CO2 + CaCO3 + H2O ↔ Ca(HCO3)2
(6) CO2 + H2O as, diệp lục→ C6H12O6 + 6O2
3. Giải bài 3.8 trang 23 SBT Hóa học 11
Cần thêm ít nhất bao nhiêu ml dung dịch Na2CO3 0,15M vào 25 ml dung dịch Al2(SO4)3 0,02M để làm kết tủa hoàn toàn ion nhôm dưới dạng Al(OH)3 ? Biết rằng phản ứng cho thoát ra khí CO2.
A. 15 ml
B. 10 ml
C. 20 ml
D. 12 ml
Phương pháp giải
PTHH: 3Na2CO3 + Al2(SO4)3 + 3H2O → 2Al(OH)3 + 3CO2 + 3Na2CO3
Tính theo PTHH → VNa2CO3
Hướng dẫn giải
3Na2CO3 + Al2(SO4)3 + 3H2O → 2Al(OH)3 + 3CO2 + 3Na2CO4
3 mol 1 mol
x mol 0,025.0,02 mol
→ x = 0,0015 mol
\({V_{N{a_2}C{O_3}}} = \dfrac{{0,0015}}{{0,15}} = 0,01(l) = 10ml\)
4. Giải bài 3.9 trang 23 SBT Hóa học 11
Hãy điền dấu (+) vào trường hợp nào có và dấu (-) vào trường hợp nào không có phản ứng hoá học xảy ra giữa các chất sau đây :
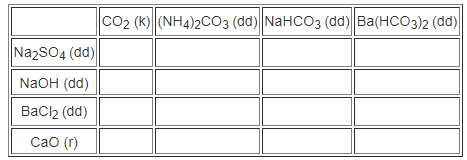
Phương pháp giải
Xem lại lí thuyết về hợp chất của Cacbon để điền dấu thích hợp vào ô trống.
Hướng dẫn giải
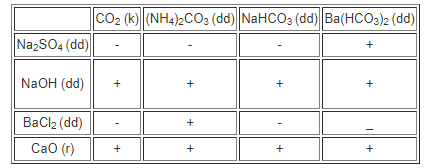
5. Giải bài 3.10 trang 23 SBT Hóa học 11
Có một hỗn hợp ba muối NH4HCO3, NaHCO3, Ca(HCO3)2. Khi nung 48,8 g hỗn hợp đó đến khối lượng không đổi, thu được 16,2 g bã rắn. Chế hoá bã rắn với dung dịch HCl lấy dư, thu được 2,24 lít khí (đktc). Xác định thành phần phần trăm của các muối trong hỗn hợp.
Phương pháp giải
PTHH:
\(N{H_4}HC{O_3}\) \(\xrightarrow{{{t^0}}}\) \(N{H_3} + C{O_2} + {H_2}O\) (1)
\(2NaHC{O_3}\) \(\xrightarrow{{{t^0}}}\) \(N{a_2}C{O_3} + C{O_2} + {H_2}O\) (2)
\(Ca{(HC{O_3})_2}\) \(\xrightarrow{{{t^0}}}\) \(CaO + 2C{O_2} + {H_2}O\) (3)
\(N{a_2}C{O_3} + 2HCl \to 2NaCl + C{O_2} + {H_2}O\) (4)
\(CaO + 2HCl \to CaC{l_2} + {H_2}O\) (5)
Từ các phương trình phản ứng, tính được khối lượng từng muối => thành phần phần trăm của các muối trong hỗn hợp.
Hướng dẫn giải
Các phản ứng phân hủy muối khi nung :
\(N{H_4}HC{O_3}\) \(\xrightarrow{{{t^0}}}\) \(N{H_3} + C{O_2} + {H_2}O\) (1)
\(2NaHC{O_3}\) \(\xrightarrow{{{t^0}}}\) \(N{a_2}C{O_3} + C{O_2} + {H_2}O\) (2)
\(Ca{(HC{O_3})_2}\) \(\xrightarrow{{{t^0}}}\) \(CaO + 2C{O_2} + {H_2}O\) (3)
Bã rắn thu được sau khi nung gồm Na2CO3 và CaO, chúng tan trong dung dịch HCl dư theo các phương trình hoá học :
\(N{a_2}C{O_3} + 2HCl \to 2NaCl + C{O_2} + {H_2}O\) (4)
\(CaO + 2HCl \to CaC{l_2} + {H_2}O\) (5)
Theo (4) :
\({n_{N{a_2}C{O_3}}} = {n_{C{O_2}}} = \dfrac{{2,24}}{{22,4}}\) = 0,1 (mol), hay 106.0,1 = 10,6 (g) \(N{a_2}C{O_3}\)
Theo (2) :
\({n_{NaHC{O_3}}} = 2.{n_{N{a_2}C{O_3}}}\) = 2.0,1 =0,2 (mol), hay 84.0,2 = 16,8 (g) \(NaHC{O_3}\).
Số mol CaO có trong bã rắn : \(\dfrac{{16,2 - 10,6}}{{56}}\) = 0,1 (mol).
Theo (3):
\({n_{Ca{{(HC{O_3})}_2}}} = {n_{CaO}}\) = 0.1 (mol), hay 162.0,1 = 16,2 (g) Ca(HCO3)2.
Khối lượng \(N{H_4}HC{O_3}\) có trong hỗn hợp : 48,8 - (16,8 + 16,2) = 15,8 (g).
Thành phần phần trăm của hỗn hợp muối :
\(\begin{array}{l}
\% {m_{N{H_4}HC{O_3}}} = \dfrac{{15,8.100\% }}{{48,8}} = 32,38\% ;\\
\% {m_{NaHC{O_3}}} = \dfrac{{16,8.100\% }}{{48,8}} = 34,43\% ;\\
\% {m_{Ca(HC{O_{3{)_2}}}}} = \dfrac{{16,2.100\% }}{{48,8}} = 33,19\% .
\end{array}\)
Tham khảo thêm
- doc Giải bài tập SBT Hóa 11 Bài 15: Cacbon
- doc Giải bài tập SBT Hóa 11 Bài 17: Silic và hợp chất của silic
- doc Giải bài tập SBT Hóa 11 Bài 18: Công nghiệp silicat
- doc Giải bài tập SBT Hóa 11 Bài 19: Luyện tập



