Giải bài tập SBT Hóa 11 Bài 29: Anken
Nhằm mục đích kiểm tra kiến thức về Anken cũng như cách vận dụng tích chất để giải bài tập. eLib xin giới thiệu đến các em học sinh nội dung giải bài tập dưới đây. Với các bài tập có phương pháp và lời giải chi tiết, hi vọng rằng đây sẽ là tài liệu giúp các bạn học tập tốt hơn.
Mục lục nội dung
1. Giải bài 6.1 trang 41 SBT Hóa học 11
2. Giải bài 6.2 trang 41 SBT Hóa học 11
3. Giải bài 6.3 trang 41 SBT Hóa học 11
4. Giải bài 6.4 trang 42 SBT Hóa học 11
5. Giải bài 6.5 trang 42 SBT Hóa học 11
6. Giải bài 6.6 trang 42 SBT Hóa học 11
7. Giải bài 6.7 trang 42 SBT Hóa học 11
8. Giải bài 6.8 trang 42 SBT Hóa học 11
9. Giải bài 6.9 trang 42 SBT Hóa học 11
10. Giải bài 6.10 trang 43 SBT Hóa học 11
11. Giải bài 6.11 trang 43 SBT Hóa học 11

1. Giải bài 6.1 trang 41 SBT Hóa học 11
Hợp chất sau có tên là gì?
CH3-C(CH3)2-CH2-CH=CH2
A. 2-đimetylpent-4-en.
B. 2,2-đimetylpent-4-en.
C. 4-đimetylpent-l-en.
D. 4,4-đimetylpent-l-en.
Phương pháp giải
- Tên thông thường của một số ít anken lấy tên từ ankan tương ứng, nhưng đổi hậu tố an thành ilen.
- Tên thay thế: số chỉ vị trí nhánh – Tên nhánh + Tên mạch chính – Số chỉ vị trí liên kết đôi – en
Hướng dẫn giải
Hợp chất CH3-C(CH3)2-CH2-CH=CH2 có tên gọi là 4,4-đimetylpent-1-en.
Đáp án D
2. Giải bài 6.2 trang 41 SBT Hóa học 11
Hợp chất CH3-CH2-C(=CH2)-CH2-CH3 có tên là gì?
A. 3-metylenpentan
B. 1,1-đietyleten
C. 2-etylbut-1-en
D. 3-etylbut-3-en
Phương pháp giải
- Tên thông thường của một số ít anken lấy tên từ ankan tương ứng, nhưng đổi hậu tố an thành ilen.
- Tên thay thế: số chỉ vị trí nhánh – Tên nhánh + Tên mạch chính – Số chỉ vị trí liên kết đôi – en
Hướng dẫn giải
Hợp chất CH3-CH2-C(=CH2)-CH2-CH3 có tên gọi là 2-etylbut-1-en.
Đáp án cần chọn là C
3. Giải bài 6.3 trang 41 SBT Hóa học 11
Nhận xét sau đây là sai ?
A. Tất cả các anken đều có công thức là CnH2n.
B. Tất cả các chất có công thức chung CnH2n đều là anken.
C. Tất cả các anken đều làm mất màu dung dịch brom.
D. Tất cả các anken đều làm mất màu dung dịch KMnO4.
Phương pháp giải
Xem lại lí thuyết về Anken
Hướng dẫn giải
A, C, D – Đúng
Tất cả các chất có công thức chung CnH2n đều là anken → sai
Đáp án cần chọn là B
4. Giải bài 6.4 trang 42 SBT Hóa học 11
Hợp chất 2,4-đimetylhex-1-en ứng với công thức cấu tạo nào cho dưới đây?
A. 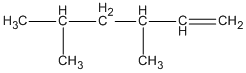
B. 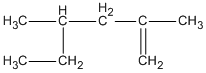
C. 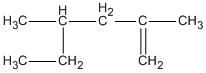
D. 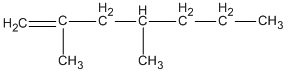
Phương pháp giải
Xem lại lí thuyết về Anken, cách gọi tên
Hướng dẫn giải
Hợp chất 2,4-đimetylhex-1-en ứng với công thức cấu tạo
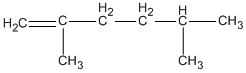
Đáp án cần chọn là B.
5. Giải bài 6.5 trang 42 SBT Hóa học 11
Để phân biệt etan và eten, dùng phản ứng nào cho dưới đây là thuận tiện nhất ?
A. Phản ứng đốt cháy
B. Phản ứng cộng với hiđro
C. Phản ứng với nước brom
D. Phản ứng trùng hợp
Phương pháp giải
Dựa vào đặc điểm của liên kết giữa etan và eten để phân biệt.
Hướng dẫn giải
Etan chỉ chứa liên kết đơn nên không có phản ứng cộng, còn eten thì có => Eten làm mất màu dung dịch nước brom, etan thì không.
Đáp án C
6. Giải bài 6.6 trang 42 SBT Hóa học 11
Trình bày phương pháp hoá học để phân biệt ba khí: etan, etilen và cacbon đioxit.
Phương pháp giải
Gợi ý: Dùng nước brom và nước vôi trong.
Hướng dẫn giải
Thử với nước brom, khí nào làm mất màu nước brom là etilen :
C2H4 + Br2 → C2H4Br2
Hai khí còn lại đem thử với nước vôi trong; chất nào làm dung dịch vẩn dục là CO2:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
7. Giải bài 6.7 trang 42 SBT Hóa học 11
Hỗn hợp khí A chứa một ankan và một anken, Khối lượng hỗn hợp A là 9 gam và thể tích là 8,96 lít. Đốt cháy hoàn toàn A, thu được 13,44 lít CO2. Các thể tích được đo ở đktc. Xác định công thức phân tử và phần trăm thể tích từng chất trong A.
Phương pháp giải
- Giả sử hỗn hợp A có x mol CnH2n+2 và y mol CmH2m
- Viết PTHH: \({C_n}{H_{2n + 2}} + \dfrac{{3n + 1}}{2}{O_2} \to nC{O_2} + (n + 1){H_2}O\)
\({C_m}{H_{2m}} + \dfrac{{3m + 1}}{2}{O_2} \to mC{O_2} + m{H_2}O\)
- Dựa theo PTHH lập hệ pt tìm ra x, y, n, m → công thức phân tử và phần trăm thể tích từng chất trong A
Hướng dẫn giải
Cách 1. Giả sử hỗn hợp A có x mol CnH2n+2 và y mol CmH2m
x + y = \(\dfrac{{8,96}}{{22,4}}\) = 0,4 (1)
(14n + 2)x + 14my = 9 (2)
\({C_n}{H_{2n + 2}} + \dfrac{{3n + 1}}{2}{O_2} \to nC{O_2} + (n + 1){H_2}O\)
x mol nx mol
\({C_m}{H_{2m}} + \dfrac{{3m + 1}}{2}{O_2} \to mC{O_2} + m{H_2}O\)
y mol my mol
nx + my = \(\dfrac{{13,44}}{{22,4}}\) = 0,6 (3)
Từ (2) và (3), dễ dàng tìm được x = 0,3 ; suy ra y = 0,1.
Thay hai giá trị đó vào (3) tìm được :
0,3n + 0,1m = 0,6 → 3n + m = 6 \( \Rightarrow n = 2 - \dfrac{m}{3}\)
Nghiệm nguyên thu được là m = 3, n = 1
CH4 chiếm 75,0% thể tích A và C3H6 chiếm 25,0%.
Cách 2. Khối lượng trung bình của 1 mol A :
\({\overline M _A} = \dfrac{9}{{0,4}}\) = 22,5(g/mol)
Trong hỗn hợp A phải có chất có M < 22,5 ; chất đó chỉ có thể là CH4.
Sau đó giải hệ
\(\left\{ \begin{array}{l}
x + y = 0,4\\
16{\rm{x}} + 14my = 9\\
x + my = 0,6
\end{array} \right.\)
tìm được m = 3 ; x = 0,3 ; y = 0,1.
8. Giải bài 6.8 trang 42 SBT Hóa học 11
0,7 g một anken có thể làm mất màu 16,0 g dung dịch brom (trong CCl4) có nồng độ 12,5%.
1. Xác định công thức phân tử chất A.
2. Viết công thức cấu tạo của tất cả các đồng phân cấu tạo ứng với công thức phân tử tìm được. Ghi tên từng đồng phân.
Phương pháp giải
1. Viết PTHH: \({C_n}{H_{2n}} + B{{\rm{r}}_2} \to {C_n}{H_{2n}}B{{\rm{r}}_2}\)
Tính theo PTHH → số mol anken →Manken
Biểu diễn Manken theo n → n → CTPT của A
2. Xem lại lí thuyết về đồng phân của Anken để viết CTCT của A.
Hướng dẫn giải
1. \({C_n}{H_{2n}} + B{{\rm{r}}_2} \to {C_n}{H_{2n}}B{{\rm{r}}_2}\)
Số mol anken = số mol Br2 = \(\dfrac{{16.12,5}}{{100.160}}\) = 0.0125 (mol).
Khối lượng 1 mol anken = \(\dfrac{{0,7}}{{0,0125}}\) = 56 (g).
14n = 56 → n = 4 → C4H8.
2. CH2 = CH - CH2 - CH3 (but-1-en) CH3 - CH = CH - CH3 (but-2-en)
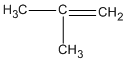 (2-metylpropen)
(2-metylpropen)
 (xiclobutan)
(xiclobutan)
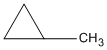 (metylxiclopropan)
(metylxiclopropan)
9. Giải bài 6.9 trang 42 SBT Hóa học 11
Hỗn hợp khí A chứa eten và hiđro. Tỉ khối của A đối với hiđro là 7,5. Dẫn A đi qua chất xúc tác Ni nung nóng thì A biến thành hỗn hợp khí B có tỉ khối đối với hiđro là 9,0. Tính hiệu suất phản ứng cộng hiđro của eten.
Phương pháp giải
Giả sử trong 1 mol hỗn hợp A có x mol C2H4 và (1 - x) mol H2
Biểu diễn MA theo x. Giải pt → x
Viết PTHH: C2H4 + H2 → C2H6
Áp dụng ĐLBTKL: mB = mA= 15 g → MB
Tính hiệu suất của phản ứng.
Hướng dẫn giải
Giả sử trong 1 mol hỗn hợp A có x mol C2H4 và (1 - x) mol H2.
MA = 28x + 2(1 - x) = 7,5.2 = 15 (g/mol) → x = 0,5.
Giả sử khi dẫn 1 mol A qua chất xúc tác Ni, có n mol \({C_2}{H_4}\) tham gia phản ứng :
C2H4 + H2 → C2H6
n mol n mol n mol
Số mol khí còn lại trong hỗn hợp B là (1 - n) mol. Theo định luật bảo toàn khối lượng: mB = mA= 15 g.
Khối lượng của 1 mol B : MB = \(\dfrac{{15}}{{1 - n}}\) = 9 x 2 = 18(g/mol) → n = 1
Hiệu suất phản ứng : H = \(\dfrac{1}{{6.0,5}}\). 100% = 33,33%.
10. Giải bài 6.10 trang 43 SBT Hóa học 11
Hỗn hợp khí A chứa hiđro và một anken. Tỉ khối của A đối với hiđro là 6,0. Đun nóng nhẹ hỗn hợp A có mặt chất xúc tác Ni thì A biến thành hỗn hợp khí B không làm mất màu nước brom và có tỉ khối đối với hiđro là 8,0. Xác định công thức phân tử và phần trăm thể tích của từng chất trong hỗn hợp A và hỗn hợp B.
Phương pháp giải
Giả sử trong 1 mol A có x mol CnH2n và (1 - x) mol H2
Biểu diễn MA theo x và n
Viết PTHH: \({C_n}{H_{2n}} + {H_2} \to {C_n}{H_{2n + 2}}\)
Biểu diễn MB theo x
Tìm x, n → công thức phân tử và phần trăm thể tích của từng chất.
Hướng dẫn giải
Giả sử trong 1 mol A có x mol CnH2n và (1 - x) mol H2.
MA = 14nx + 2(1 - x) = 2.6 = 12 (g/mol) (1)
Khi đun nóng 1 mol A có mặt chất xúc tác Ni, tất cả anken đã chuyển hết thành ankan (vì B không làm mất màu nước brom).
\({C_n}{H_{2n}} + {H_2} \to {C_n}{H_{2n + 2}}\)
x mol x mol x mol
Số mol khí trong hỗn hợp B là (1 - x)
Khối lượng hỗn hợp B = khối lượng hỗn hợp A = 12 (g). Do đó :
MB = \(\dfrac{{12}}{{1 - x}}\) = 8.2 = 16(g/mol) \( \Rightarrow \) x = 0,25.
Thay x = 0,25 vào (1), tìm được n = 3.
Hỗn hợp A : C3H6 25% ; H2 : 75%.
Hỗn hơp B : \({C_3}{H_8}:\dfrac{{0,25}}{{0,75}}\). 100% = 33,33%
H2 : 66,67%.
11. Giải bài 6.11 trang 43 SBT Hóa học 11
Hỗn hợp khí A chứa hiđro và 2 anken kế tiếp nhau trong dãy đồng đẳng. Tỉ khối của A đối với hiđro là 8,26. Đun nóng nhẹ hỗn hợp A có mặt chất xúc tác Ni thì A biến thành hỗn hợp khí B không làm mất màu nước brom và có tỉ khối đối với hiđro là 11,80. Xác định công thức phân tử và phần trăm thể tích của từng chất trong hỗn hợp A và hỗn hợp B.
Phương pháp giải
Sử dụng phương pháp trung bình
- Gọi công thức của anken là: \({C_{\overline n }}{H_{2\overline n }}\), dựa vào dữ kiện đề bài tìm \(\overline n \) →Công thức 2 anken.
- Gọi số mol từng anken lần lượt là a, b(mol).
Lập hệ pt → a, b → phần trăm thể tích của từng chất.
Hướng dẫn giải
Trong 1 mol A có x mol 2 anken (có công thức chung là \({C_{\overline n }}{H_{2\overline n }}\)) và (1 - x) mol H2 :
MA = 14\({\overline n }\)x + 2(1 - x) = 8,26 x 2 = 16,52 (g/mol). (1)
\({C_{\overline n }}{H_{2\overline n }} + {H_2} \to {C_{\overline n }}{H_{2\overline n + 2}}\)
x mol x mol x mol
MB = \(\dfrac{{16,52}}{{1 - x}}\) = 11,8 x 2 = 23,6 (g/mol); \( \Rightarrow \) x = 0,3
Thay x = 0,3 vào (1), tìm được n = 3,6.
Công thức của 2 anken là C3H6 (a mol) và C4H8 (b mol)
\(\left. \begin{array}{l}
a + b = 0,3\\
\dfrac{{3{\rm{a}} + 4b}}{{a + b}} = 3,6
\end{array} \right\}a = 0,12;b = 0,18\)
Hỗn hợp A : C3H6 : 12% ; C4H8 : 18% ; H2 : 70%.
Hỗn hợp B : \({C_3}{H_8}:\dfrac{{0,12}}{{0,7}}\). 100% = 17%;
\({C_4}{H_{10}}:\dfrac{{0,18}}{{0,7}}\). 100% = 26%;
H2 chiếm 57%.
12. Giải bài 6.12 trang 43 SBT Hóa học 11
Hỗn hợp khí A chứa hiđro, một ankan và một anken. Dẫn 13,44 lít A đi qua chất xúc tác Ni nung nóng thì thu được 10,08 lít hỗn hợp khí B. Dẫn B đi qua bình đựng nước brom thì màu của dung dịch nhạt đi, khối lượng của bình tăng thêm 3,15 g. Sau thí nghiệm, còn lại 8,4 lít hỗn hợp khí C có tỉ khối đối với hiđro là 17,80. Biết các thể tích được đo ở đktc và các phản ứng đều xảy ra hoàn toàn. Xác định công thức phân tử và phần trăm thể tích của từng chất trong mỗi hỗn hợp A, B và C.
Phương pháp giải
- Tính số mol khí trong A, B, C.
- Gọi công thức của ankan là: CnH2n+2 anken là: CmH2m
- Dựa vào tính chất hóa học của từng chất → xác định từng chất trong A, B, C.
- Khai thác dữ kiện đề bài tìm n, m → CTPT cần tìm từ đó tính phần trăm thể tích từng chất.
Hướng dẫn giải
Số mol khí trong hỗn hợp A là \(\dfrac{{13,44}}{{22,4}}\) = 0,6 ; trong B là \(\dfrac{{10,08}}{{22,4}}\) = 0,45 và trong C là \(\dfrac{{8.4}}{{22,4}}\) = 0,375.
A chứa H2, CnH2n+2 và CmH2m. Khi A đi qua chất xúc tác Ni :
\({C_m}{H_{2m}} + {H_2} \to {C_m}{H_{2m + 2}}\)
B chứa CnH2n+2, CmH2m+2 và CmH2m còn dư.
Số mol H2 trong A là : 0,6 - 0,45 = 0,15 (mol).
Đó cũng là số mol CmH2m+2 trong B.
Khi B đi qua nước brom thì CmH2m bị giữ lại: CmH2m + Br2 → CmH2mBr2.
Số mol CmH2m trong B là : 0,45 - 0,375 = 0,075 (mol).
Khối lượng 1 mol \({C_m}{H_{2m}}\) = 14m = \(\dfrac{{3,15}}{{0,075}}\) = 42(g) \( \Rightarrow \) m = 3.
Anken là C3H6 và ankan do chất đó tạo ra là \({C_3}{H_8}\).
Trong hỗn hợp C có 0,15 mol C3H8 và 0,375 - 0,15 = 0,225 mol CnH2n+2
Khối lượng hỗn hợp C là : 0,375. 17,8. 2 = 13,35 (g).
→ 0,15.44 + 0,225(14n + 2) = 13,35 \( \Rightarrow \) n = 2
Ankan là C2H6.
A chứa C2H6 (37,5%) ; C3H6 (37,5%) và H2 (25%) ;
B chứa C2H6 (50%) ; C3H8 (33,3%) và C3H6 (16,7%) ; C chứa C2H6 (60%) và C3H8 (40%).
13. Giải bài 6.13 trang 43 SBT Hóa học 11
Hỗn hợp khí A chứa hiđro, một ankan và một anken. Đốt cháy hoàn toàn 100 ml A, thu được 210 ml khí CO2. Nếu đun nóng nhẹ 100 ml A có mặt chất xúc tác Ni thì còn lại 70 ml một chất khí duy nhất. Các thể tích khí đều đo ở cùng một điều kiện.
1. Xác định công thức phân tử và phần trăm thể tích của từng chất trong hỗn hợp A.
2. Tính thể tích oxi vừa đủ để đốt cháy hoàn toàn 100 ml A.
Phương pháp giải
- Giả sử trong 100 ml A có x ml CnH2n+2 ; y ml CnH2n và z ml H2.
- Viết PTHH: \({C_n}{H_{2n + 2}} + \dfrac{{3n + 1}}{2}{O_2} \to nC{O_2} + (n + 1){H_2}O\)
\({C_n}{H_{2n}} + \dfrac{{3n}}{2}{O_2} \to nC{O_2} + n{H_2}O\)
\(2{H_2} + {O_2} \to 2{H_2}O\)
\({C_n}{H_{2n}} + {H_2} \to {C_n}{H_{2n + 2}}\)
- Khai thác dữ kiện đề bài, giải hệ phương trình → x, y, z, n sau đó trả lời yêu cầu bài toán.
Hướng dẫn giải
1. Khi đun nóng A có mặt chất xúc tác Ni, chỉ còn lại 1 chất khí duy nhất. Vậy ankan và anken trong A có cùng số nguyên tử cacbon.
Giả sử trong 100 ml A có x ml CnH2n+2 ; y ml CnH2n và z ml H2.
x + y + z = 100 (1)
Khi đốt cháy hoàn toàn 100 ml A :
\({C_n}{H_{2n + 2}} + \dfrac{{3n + 1}}{2}{O_2} \to nC{O_2} + (n + 1){H_2}O\)
x ml nx mol
\({C_n}{H_{2n}} + \dfrac{{3n}}{2}{O_2} \to nC{O_2} + n{H_2}O\)
y ml ny mol
\(2{H_2} + {O_2} \to 2{H_2}O\)
Thể tích CO2: n(x + y) = 210 (2)
Khi đun nóng A có mặt chất xúc tác Ni :
\({C_n}{H_{2n}} + {H_2} \to {C_n}{H_{2n + 2}}\)
y mol y mol y mol
→ x + y = 70 (3)
→ y = z (4)
Giải hệ phương trình, tìm được n = 3 ; x = 40 ; y = z = 30.
Thành phần thể tích của hỗn hợp A là: C3H8: 40%; C3H6: 30% ; H2 : 30%
2. Thể tích O2 là 350 ml.
Tham khảo thêm
- doc Giải bài tập SBT Hóa 11 Bài 30: Ankađien
- doc Giải bài tập SBT Hóa 11 Bài 31: Luyện tập: Anken và ankađien
- doc Giải bài tập SBT Hóa 11 Bài 32: Ankin
- doc Giải bài tập SBT Hóa 11 Bài 33: Luyện tập Ankin



