Giải bài tập SBT Hóa 11 Bài 42: Luyện tập: Dẫn xuất halogen, ancol, phenol
Lời giải chi tiết và chính xác cho 7 bài tập trang 64,65 SBT Hóa lớp 11 đã được eLib sưu tầm và tổng hợp dưới đây sẽ giúp các em học tập thật tốt chuyên đề Dẫn xuất halogen, ancol, phenol. Mời các bạn tải về tham khảo chuẩn bị cho bài học sắp tới.
Mục lục nội dung

1. Giải bài 8.28 trang 64 SBT Hóa học 11
Cho lần lượt các chất C2H5Cl, C2H5OH, C6H5OH vào dung dịch NaOH đun nóng. Số chất phản ứng là ?
A. Không chất nào.
B. Một chất.
C. Hai chất.
D. Cả ba chất.
Phương pháp giải
Học sinh tổng hợp kiến thức về dẫn xuất halogen, ancol, phenol để trả lời yêu cầu bài toán.
Hướng dẫn giải
C2H5Cl và C6H5OH phản ứng với dung dịch NaOH đun nóng.
C2H5Cl + NaOH → C2H5OH + NaCl
C6H5OH + NaOH → C6H5ONa + H2O
Đáp án cần chọn là C.
2. Giải bài 8.29 trang 64 SBT Hóa học 11
Đun chất
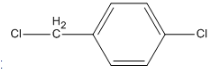
với dung dịch NaOH có dư. Sản phẩm hữu cơ thu được là chất nào dưới đây ?
.png)
Phương pháp giải
Xem lại lí thuyết về phenol
Nguyên tử -Cl gắn ngoài vòng sẽ bị thay thế bởi nhóm -OH, còn nguyên tử -Cl gắn trực tiếp vào vòng thì không phản ứng.
Hướng dẫn giải
Sản phẩm thu được là
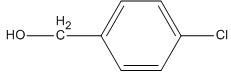
3. Giải bài 8.30 trang 64 SBT Hóa học 11
Viết phương trình phản ứng hóa học thực hiện các biến hóa dưới đây. Ghi rõ điều kiện của phản ứng (nếu có).
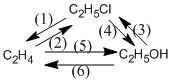
Phương pháp giải
Học sinh tổng hợp kiến thức về dẫn xuất halogen, ancol, phenol để viết các PTHH.
Hướng dẫn giải
(1) C2H5Cl + NaOH → CH2=CH2 + NaCl + H2O (đk: to, ancol)
(2) CH2=CH2 + Cl → CH3−CH2−Cl (mt: H+)
(3) C2H5OH + HCl (to) → C2H5Cl + H2O
(3) C2H5Cl + NaOH → C2H5OH + NaCl (đk: to, H2O)
(5) CH2=CH2 + H2O → CH3−CH2−OH (mt: H+)
(6) C2H5OH → CH2=CH2 + H2O (đk:170oC, H2SO4)
4. Giải bài 8.31 trang 65 SBT Hóa học 11
Cho chất sau lần lượt tác dụng với
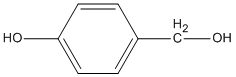
1. Na
2. dung dịch NaOH
3. dung dịch HBr
4. CuO (đun nóng nhẹ).
Viết phương trình hoá học của các phản ứng xảy ra.
Phương pháp giải
Học sinh tổng hợp kiến thức về ancol , phenol để viết PTHH
Hướng dẫn giải
1. HO−C6H4−CH2OH + 2Na → Na−O−C6H4−CH2−ONa + H2
2. HO−C6H4−CH2OH + NaOH → NaO−C6H4−CH2OH + H2O
3. HO−C6H4−CH2OH + HBr → HO−C6H4−CH2Br + H2O
4. HO−C6H4−CH2OH + CuO → HO−C6H4−CHO + Cu + H2O
5. Giải bài 8.32 trang 65 SBT Hóa học 11
Chất A là một ancol no, đơn chức, mạch hở. Đun m gam A với H2SO4 đặc ở 170oC thu được 17,85 gam anken (hiệu suất 85%). Cũng m gam A khi tác dụng với HBr tạo ra 36,9 gam dẫn xuất brom (hiệu suất 60%).
1. Xác định công thức phân tử, công thức cấu tạo và tên của ancol A.
2. Tính giá trị m.
Phương pháp giải
- Áp dụng công thức tính hiệu suất: \(H(\% ) = \dfrac{{{m_{tt}}}}{{{m_{lt}}}} \times 100\% \)
- Viết PTHH:
\({C_n}{H_{2n + 1}}OH\) \(\xrightarrow[{{{170}^0}C}]{{{H_2}S{O_4}}}\)\({C_n}{H_{2n}} + {H_2}O\)
\({C_n}{H_{2n + 1}}OH + HB{\rm{r}} \to {C_n}{H_{2n + 1}}B{\rm{r}} + {H_2}O\)
- Tính theo PTHH trả lời yêu cầu bài toán.
Hướng dẫn giải
1. Nếu hiệu suất các phản ứng là 100% thì :
- Khối lượng anken thu được là: \(\dfrac{{17,85.100}}{{85}}\) = 21(g).
- Khối lương dẫn xuất brom thu đươc là: \(\dfrac{{36,9.100}}{{60}}\) = 61,5(g)
\({C_n}{H_{2n + 1}}OH\) \(\xrightarrow[{{{170}^0}C}]{{{H_2}S{O_4}}}\)\({C_n}{H_{2n}} + {H_2}O\)
x mol x mol
\({C_n}{H_{2n + 1}}OH + HB{\rm{r}} \to {C_n}{H_{2n + 1}}B{\rm{r}} + {H_2}O\)
x mol x mol
14nx = 21 ; (14n + 81)x = 61,5
→ x = 0,5 ; n = 3.
Ancol A có CTPT C3H8O và có CTCT
CH3 - CH2 - CH2 - OH ( propan-1-ol ) hoặc CH3-CH(OH)-CH3 ( propan-2-ol )
2. m = 0,5.60 = 30 (g)
6. Giải bài 8.33 trang 65 SBT Hóa học 11
Chất A là một ancol có mạch cacbon không phân nhánh. Đốt cháy hoàn toàn m gam A, người ta thu được 2,24 lít CO2 (đktc) và 2,25g H2O. Mặt khác, nếu cho 18,55 g A tác dụng hết với natri, thu được 5,88 lít H2 (đktc).
1. Hãy xác định công thức phân tử, công thức cấu tạo và tên của chất A.
2. Tính giá trị m.
Phương pháp giải
- So sánh số mol H2O và CO2 để kết luận đặc điểm của ancol (số mol H2O tạo thành > số mol CO2. Vậy, A phải là ancol no, mạch hở.)
- Gọi A có dạng: CnH2n+2-x(OH)x hay CnH2n+2Ox
- Viết PTHH:
\({C_n}{H_{2n + 2}}{O_x} + \dfrac{{3n + 1 - x}}{2}{O_2} \to nC{O_2} + (n + 1){H_2}O\)
\({C_4}{H_{10 - x}}{(OH)_x} + xNa \to {C_4}{H_{10 - x}}{(ONa)_x} + \dfrac{x}{2}{H_2}O\)
- Dựa theo PTHH, lập phương trình ẩn x, giải pt → CTPT của A.
2. Tính số mol A theo số mol CO2 → m
Hướng dẫn giải
1. Số mol CO2 = \(\dfrac{{2,24}}{{22,4}}\) = 0,1 (mol).
Số mol H2O = \(\dfrac{{2,25}}{{18}}\) =0,125 (mol).
Khi đốt ancol A, số mol H2O tạo thành > số mol CO2. Vậy, A phải là ancol no, mạch hở. A có dạng CnH2n+2-x(OH)x hay CnH2n+2Ox.
\({C_n}{H_{2n + 2}}{O_x} + \dfrac{{3n + 1 - x}}{2}{O_2} \to nC{O_2} + (n + 1){H_2}O\)
Theo đầu bài ta có : \(\dfrac{n}{{n + 1}} = \dfrac{{0,1}}{{0,125}}\) \( \Rightarrow \) n = 4.
\({C_4}{H_{10 - x}}{(OH)_x} + xNa \to {C_4}{H_{10 - x}}{(ONa)_x} + \dfrac{x}{2}{H_2}O\)
Theo phương trình : Cứ (58 + 16x) g A tạo ra 0,5000x mol H2.
Theo đầu bài : Cứ 18,55 g A tạo ra \(\dfrac{{5,88}}{{22,4}}\) = 0,2625 mol H2.
\( \Rightarrow \dfrac{{58 + 16{\rm{x}}}}{{18,55}} = \dfrac{{0,5{\rm{x}}}}{{0,2625}} \Rightarrow x = 3\)
CTPT của A là C4H10O3.
Theo đầu bài A có mạch cacbon không nhánh ; như vậy các CTCT thích hợp là
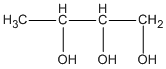 butan-1,2,3 triol
butan-1,2,3 triol
và 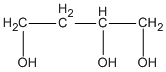 butan-1,2,4-triol.
butan-1,2,4-triol.
2. Để tạo ra 0,1 mol CO2 ; số mol A cần đốt là : \(\dfrac{{0,1}}{4}\) = 0,025 (mol).
Như vậy : m = 0,025.106 = 2,65 (g).
7. Giải bài 8.34 trang 65 SBT Hóa học 11
Một bình kín dung tích 5,6 lít có chứa hỗn hợp hơi của hai ancol đơn chức và 3,2g O2. Nhiệt độ trong bình là 109,2oC, áp suất trong bình là 0,728 atm.
Bật tia lửa điện để đốt cháy hoàn toàn hai ancol, sau phản ứng nhiệt độ trong bình là 136,5oC và áp suất là p atm.
Dẫn các chất trong bình sau phản ứng qua bình (1) đựng H2SO4 đặc (dư), sau đó qua bình (2) đựng dung dịch NaOH (dư), thấy khối lượng bình (1) tăng 1,26 g, khối lượng bình (2) tăng 2,2 g.
1. Tính p, biết rằng thể tích bình không đổi.
2. Xác định công thức phân tử, công thức cấu tạo, phần trăm khối lượng và gọi tên từng chất trong hỗn hợp ancol biết rằng số mol của ancol có phân tử khối nhỏ hn gấp 2 lần số mol của ancol có phân tử khối lớn hơn.
Phương pháp giải
1. Đổi thể tích hỗn hợp khí trong bình trước phản ứng về đktc dựa vào công thức: \({V_o} = \dfrac{{{p_1}{V_1}}}{{{T_1}}}.\dfrac{{{T_o}}}{{{p_o}}}\)
- Tính số mol các chất trước phản ứng.
- Viết PTHH:
\(\begin{array}{l}
{C_x}{H_y}O + (x + \dfrac{y}{4} - \dfrac{1}{2}){O_2} \to xC{O_2} + \dfrac{y}{2}{H_2}O\\
{C_{x'}}{H_{y'}}O + (x' + \dfrac{{y'}}{4} - \dfrac{1}{2}){O_2} \to x'C{O_2} + \dfrac{{y'}}{2}{H_2}O\\
{H_2}S{O_4} + n{H_2}O \to {H_2}S{O_4}.n{H_2}O\\
2NaOH + C{O_2} \to N{a_2}C{O_3} + {H_2}O
\end{array}\)
- Dựa theo PTHH, tính toán, tính số mol các chất sau phản ứng.
- Dựa vào công thức : \(\dfrac{{pV}}{T} = \dfrac{{{P_o}V{'_o}}}{{{T_o}}} \Rightarrow p = \dfrac{{{P_o}V{'_o}}}{{{T_o}}}.\dfrac{T}{V}\) → p
2. Giả sử CxHyO có PTK nhỏ hơn Cx'Hy'O ; như vậy số mol CxHyO sẽ là 0,02 và số mol Cx'Hy'O là 0,01.
- Biện luận x, y, và x', y' theo dữ kiện đề bài → trả lời yêu cầu bài toán.
Hướng dẫn giải
1. Đổi thể tích hỗn hợp khí trong bình trước phản ứng về đktc :
\({V_o} = \dfrac{{{p_1}{V_1}}}{{{T_1}}}.\dfrac{{{T_o}}}{{{p_o}}} = \dfrac{{0,728.5,6}}{{273 + 109,2}}.\dfrac{{273}}{1}\) = 2,912 (lít)
Số mol các chất trong bình trước phản ứng là : \(\dfrac{{2,912}}{{22,4}}\) = 0,13 (mol).
Số mol O2 = \(\dfrac{{3,2}}{{32}}\) = 0,1 (mol) → Số mol 2 ancol = 0,13 - 0,1 = 0,03 (mol).
Khi 2 ancol cháy :
\(\begin{array}{l}
{C_x}{H_y}O + (x + \dfrac{y}{4} - \dfrac{1}{2}){O_2} \to xC{O_2} + \dfrac{y}{2}{H_2}O\\
{C_{x'}}{H_{y'}}O + (x' + \dfrac{{y'}}{4} - \dfrac{1}{2}){O_2} \to x'C{O_2} + \dfrac{{y'}}{2}{H_2}O\\
{H_2}S{O_4} + n{H_2}O \to {H_2}S{O_4}.n{H_2}O\\
2NaOH + C{O_2} \to N{a_2}C{O_3} + {H_2}O
\end{array}\)
Số mol H2O là: \(\dfrac{{1,26}}{{18}}\) = 0,07 (mol) ;
Số mol \(C{O_2}\) là : \(\dfrac{{2,2}}{{44}}\) = 0,05 (mol).
Theo định luật bảo toàn khối lượng :
\({m_{{O_2}du}} = {m_{{O_2}ban{\rm{d}}au}} + {m_{Ot{\rm{r}}ong{\rm{a}}ncol}} - {m_{Ot{\rm{r}}ong{H_2}O}} - {m_{Ot{\rm{r}}ongC{O_2}}}\)
= 3,2 + 0,03.16 - 0,07.16 - 0,05.32 = 0,96 (g).
Số mol O2 còn dư : \(\dfrac{{0,96}}{{32}}\) = 0,03 (mol).
Tổng số mol các chất trong bình sau phản ứng :
0,07 + 0,05 + 0,03 = 0,15 (mol).
Thể tích của 0,15 mol khí ở đktc là : V0 = 0,15.22,4 = 3,36 (lít).
Thực tế, sau phản ứng V = 5,6 lít.
\(\dfrac{{pV}}{T} = \dfrac{{{P_o}V{'_o}}}{{{T_o}}} \Rightarrow p = \dfrac{{{P_o}V{'_o}}}{{{T_o}}}.\dfrac{T}{V} = \dfrac{{1.3,36}}{{273}}.\dfrac{{(273 + 136,5)}}{{5,6}} = 0,9(atm)\)
2. Giả sử CxHyO có PTK nhỏ hơn Cx'Hy'O ; như vậy số mol CxHyO sẽ là 0,02 và số mol Cx'Hy'O là 0,01.
Số mol CO2 sẽ là 0,02x + 0,01x' = 0,05 (mol) hay 2x + x' = 5.
x và x' là số nguyên : x = 1 ; x' = 3
hoặc x = 2 ; x' = 1
Cặp x = 2 ; x' = 1 loại vì trái với điều kiện : CxHyO có PTK nhỏ hơn Cx'Hy'O
Vậy, một ancol là CH4O và chất còn lại C3Hy'O.
Số mol H2O là 0,02.2 + 0,01.\(\dfrac{{y'}}{2}\) = 0,07 (mol).
→ y' = 6 → Ancol còn lại là C3H6O.
% về khối lượng của CH4O hay CH3 - OH (ancol metylic) :
\(\dfrac{{0,02.32}}{{0,02.32 + 0,01.58}}\).100% = 52,46%.
% về khối lượng của C3H6O hay CH2 = CH - CH2 - OH (ancol anlylic) : 100,00% - 52,46% = 47,54%.
Tham khảo thêm
- doc Giải bài tập SBT Hóa 11 Bài 39: Dẫn xuất halogen của hiđrocacbon
- doc Giải bài tập SBT Hóa 11 Bài 40: Ancol
- doc Giải bài tập SBT Hóa 11 Bài 41: Phenol



