Giải bài tập SBT Hóa 11 Bài 41: Phenol
Dưới đây là Hướng dẫn giải Hóa 11 SBT Chương 8 Bài 41 Phenol dụng eLib biên soạn và tổng hợp, nội dung bám sát theo chương trình Hóa học 11 giúp các em học sinh nắm vững phương pháp giải bài tập và ôn tập kiến thức hiệu quả hơn.
Mục lục nội dung

1. Giải bài 8.21 trang 63 SBT Hóa học 11
Chất nào sau đây không phải là phenol ?
A. 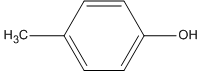
B. .png)
C. .png)
D. .png)
Phương pháp giải
Phenol là những hợp chất hữu cơ trong phân tử có nhóm -OH liên kết trực tiếp với nguyên tử C của vòng benzen
Hướng dẫn giải
.png)
Không phải là phenol
→ Chọn B.
2. Giải bài 8.22 trang 63 SBT Hóa học 11
Chất sau có tên là gì?
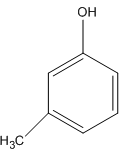
A. 4-metylphenol
B. 2-metylphenol
C. 5-metylphenol
D. 3-metylphenol
Phương pháp giải
Xem lại lí thuyết về Phenol
Hướng dẫn giải
Chất trên có tên gọi là 3-metylphenol
Đáp án D
3. Giải bài 8.23 trang 63 SBT Hóa học 11
Viết phương trình hoá học của phản ứng (nếu có) khi cho C6H5-OH và C6H5CH2-OH tác dụng với:
1. Na
2. Dung dịch NaOH
3. Dung dịch HBr (có mặt H2SO4 đặc, đun nóng).
Ghi tên các chất hữu cơ có trong phương trình hoá học.
Phương pháp giải
Xem lại lí thuyết về Phenol để viết phương trình hóa học phù hợp
Hướng dẫn giải
1. 2C6H5OH (phenol)+ 2Na → 2C6H5ONa(natri phenolat) + H2
2C6H5CH2OH + 2Na → 2C6H5CH2ONa (natri benzylat) + H2
2. C6H5OH + NaOH → C6H5ONa + H2O
C6H5CH2OH không có phản ứng
3. C6H5OH không có phản ứng
C6H5CH2OH + HBr (to, H2SO4) → C6H5CH2Br (benzyl bromua) + H2O
4. Giải bài 8.24 trang 63 SBT Hóa học 11
Chứng minh rằng trong phân tử phenol C6H5OH, gốc -C6H5 đã có ảnh hưởng đến tính chất của nhóm -OH và nhóm -OH đã có ảnh hưởng đến tính chất của gốc -C6H5.
Phương pháp giải
Nhận xét về đặc điểm của nhóm OH từ đó rút ra kết luận.
Hướng dẫn giải
- So sánh C2H5OH với C6H5OH, ta thấy:
C2H5OH không tác dụng với NaOH;
C6H5OH tác dụng dễ dàng với dung dịch NaOH
C6H5OH + NaOH → C6H5ONa + H2O
Vậy: Gốc - C6H5 đã làm tăng khả năng phản ứng của nguyên tử H thuộc nhóm -OH trong phân tử phenol so với trong phân tử ancol.
- So sánh C6H6 với C6H5OH, ta thấy:
C6H6 không tác dụng với nước brom;
C6H5OH tác dụng với nước brom tạo ra kết tủa trắng:
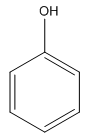 + 3Br2 →
+ 3Br2 →  + 3HBr
+ 3HBr
Vậy: Do ảnh hưởng của nhóm OH, nguyên tử H của gốc - C6H5 trong phân tử phenol dễ bị thay thế hơn nguyên tử H trong phân tử C6H6.
5. Giải bài 8.25 trang 63 SBT Hóa học 11
Sục khí cacbonic vào dung dịch natri phenolat ở nhiệt độ thường, thấy dung dịch vẩn đục, sau đó đun nóng dung dịch thì dung dịch lại trong. Giải thích những hiện tượng vừa nêu và viết phương trình hoá học (nếu có).
Phương pháp giải
Xem lại lí thuyết về Phenol
Hướng dẫn giải
Phenol có tính axit yếu, yếu hơn cả axit cacbonic. Vì vậy, axit cacbonic đẩy được phenol ra khỏi natri phenolat:
C6H5ONa + H2O + CO2 → C6H5OH + NaHCO3
Ở nhiệt độ thường, phenol rất ít tan trong nước, vì vậy, các phân tử phenol không tan làm cho dung dịch vẩn đục.
Ớ nhiệt độ cao, phenol tan rất tốt trong nước (trên 70°C, tan vô hạn trong nước). Vì thế, khi đun nóng, phenol tan hết và dung dịch lại trong.
6. Giải bài 8.26 trang 63 SBT Hóa học 11
Hỗn hợp M gồm ancol metylic, ancol etylic và phenol. Cho 14,45 g M tác dụng với Na (lấy dư), thu được 2,806 lít H2 (ở 27oC và 750 mm Hg). Mặt khác 11,56g M tác dụng vừa hết với 80 ml dung dịch NaOH 1M. Tính phần trăm khối lượng từng chất trong hỗn hợp M.
Phương pháp giải
- Từ dữ kiện "11,56 g M tác dụng vừa hết với 80 ml dung dịch NaOH 1M" tính số mol phenol theo số mol NaOH (do 2 chất còn lại không tác dụng với NaOH).
- Khi 14,45g M tác dụng với Na, các PTHH xảy ra:
2C6H5OH + 2Na → 2C6H5ONa + H2
2CH3OH + 2Na → 2CH3ONa + H2
2C2H5OH + 2Na → 2C2H5ONa + H2
-Tính số mol H2 theo công thức PV = nRT
- Lập hệ phương trình để tìm số mol mỗi ancol → phần trăm khối lượng từng chất trong hỗn hợp M.
Hướng dẫn giải
Khi 11,56 g M tác dụng với dung dịch NaOH :
\({C_6}{H_5}OH + NaOH \to {C_6}{H_5}ON{\rm{a}} + {H_2}O\)
Số mol C6H5OH trong 11,56 g M = số mol NaOH = \(\dfrac{{1.80}}{{1000}} = 0,08(mol)\)
Số mol C6H5OH trong 14,45 g M = \(\dfrac{{0,08.14,45}}{{11,45}} = 0,1(mol)\)
Khi 14,45g M tác dụng với Na :
2C6H5OH + 2Na → 2C6H5ONa + H2
0,1 mol 0,05 mol
2CH3OH + 2Na → 2CH3ONa + H2
x mol 0,5x mol
2C2H5OH + 2Na → 2C2H5ONa + H2
y mol 0,5y mol
Đổi thể tích H2 về đktc :
\({V_o} = \dfrac{{pV}}{T}.\dfrac{{{T_o}}}{{{p_o}}} = \dfrac{{750.2,806}}{{273 + 27}}.\dfrac{{273}}{{760}} = 2,52(l)\)
Số mol H2 =
\(\begin{array}{l}
0,05 + 0,5{\rm{x}} + 0,5y = \dfrac{{2,52}}{{22,4}}(mol)\\
\Rightarrow x + y = 0,125 (1)
\end{array}\)
Mặt khác 0,1.94 + 32x + 46y = 14,45
→ 32x + 46y = 5,05 (2)
Từ (1) và (2), tìm được x = 0,05 ; y = 0,075.
Thành phần khối lượng các chất trong hỗn hợp :
C6H5OH chiếm : \(\dfrac{{0,1.94}}{{14,45}}.100\% = 65\% \)
CH3OH chiếm : \(\dfrac{{0,05.32}}{{14,45}}.100\% = 11\% \)
C2H5OH chiếm : \(\dfrac{{0,075.46}}{{14,45}}.100\% = 24\% \)
7. Giải bài 8.27 trang 64 SBT Hóa học 11
Để đốt cháy hoàn toàn 2,70 g chất hữu cơ A phải dùng vừa hết 4,76 lít O2 (đktc). Sản phẩm thu được chỉ có CO2 và H2O trong đó khối lượng CO2 hơn khối lượng H2O 5,9 g.
1. Xác định công thức đơn giản nhất của A.
2. Xác định công thức phân tử biết rằng phân tử khối của A nhỏ hơn phân tử khối của glucozơ (C6H12O6).
3. Viết các công thức cấu tạo có thể có của A biết rằng A là hợp chất thơm. Ghi tên ứng với mỗi công thức.
4. Chất A có tác dụng với Na và với NaOH được không ?
Phương pháp giải
1. Áp dụng định luật bảo toàn khối lượng
mA + mO2 = mCO2 + mH2O = 9,5g
- Dựa vào dữ kiện khối lượng CO2 hơn khối lượng H2O 5,9 g=> mCO2 và mH2O
- Tính mC, mH, mO (nếu có)
- Xác định công thức đơn giản nhất của A
2. Dựa vào phân tử khối của glucozơ, biện luận để tìm CTPT của A.
3,4. Viết các CTCT của A và trả lời yêu cầu bài toán.
Hướng dẫn giải
1. CTĐGN là C7H8O
2. CTPT là C7H8O
3. Có 5 CTCT phù hợp :
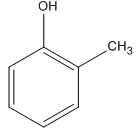
2-metylphenol (A1)
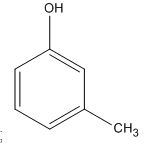
3-metylphenol (A2)
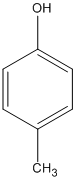
4-metylphenol (A3)
.png)
ancol benzylic (A4)
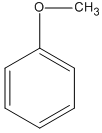
metyl phenyl ete (A5)
4. Có phản ứng với Na: A1,A2,A3,A4
Có phản ứng với dung dịch NaOH: A1,A2,A3
Tham khảo thêm
- doc Giải bài tập SBT Hóa 11 Bài 39: Dẫn xuất halogen của hiđrocacbon
- doc Giải bài tập SBT Hóa 11 Bài 40: Ancol
- doc Giải bài tập SBT Hóa 11 Bài 42: Luyện tập: Dẫn xuất halogen, ancol, phenol



