Giải bài tập SGK Hóa 11 Bài 27: Luyện tập Ankan và xicloankan
Nhằm củng cố và vận dụng đã kiến thức đã học của ankan và xicloankan vào bài tập. eLib xin chia sẻ với các em nội dung giải bài tập SGK dưới đây. Với nội dung các bài tập có phương pháp giải và hướng dẫn giải chi tiết, hi vọng rằng đây sẽ là tài liệu giúp các em học tập tốt hơn.
Mục lục nội dung

1. Giải bài 1 trang 123 SGK Hóa học 11
Viết các công thức cấu tạo của các ankan sau: pentan, 2-metylbutan, isobutan. Các chất trên còn có tên gọi nào khác không?
Phương pháp giải
Để giải bài tập này các em cần nắm vững cách viết công thức hóa học và gọi tên của ankan
Hướng dẫn giải
CH3CH2CH2CH2CH3: pentan còn có thể gọi là n-pentan
CH3-CH(CH3)-CH2-CH3 : 2-metylbutan còn có thể gọi là isopentan
CH3-CH(CH3)-CH3 : isobutan còn có thể gọi là 2-metylpropan
2. Giải bài 2 trang 123 SGK Hóa học 11
Ankan Y mạch không nhánh có công thức đơn giản nhất là C2H5
a) Tìm công thức phân tử, viết công thức cấu tạo và gọi tên chất Y
b) Viết phương trình hóa học phản ứng của Y với clo khi chiếu sáng, chỉ rõ sản phẩm chính của phản ứng.
Phương pháp giải
a) Ankan có dạng CnH2n+2
(C2H5)x → 5x = 2x + 2 ( số nguyên tử H = 2C + 2)
→ x = ? → CTPT của Y
b) Ghi nhớ quy tắc thế: Clo thế vào cacbon bậc cao hơn sẽ cho sản phẩm chính.
Hướng dẫn giải
a) Ankan có CTPT dạng (C2H5)n ⇒ C2nH5n
Vì là ankan nên: 5n = 2n x 2 + 2 ⇒ n = 2
Vậy CTCT của Y là CH3-CH2-CH2-CH3 (butan)
b) Phương trình hóa học phản ứng của Y với clo khi chiếu sáng:
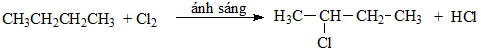
(sản phẩm chính)
Sản phẩm chính là thế Cl ở vị trí Cacbon bậc cao
Sản phẩm phụ là thế Cl ở vị trí Cacbon bậc thấp
3. Giải bài 3 trang 123 SGK Hóa học 11
Đốt cháy hoàn toàn 3,36 lít hỗn hợp khí A gồm metan và etan thu được 4,48 lít khí cacbonic. Các thể khí được đo ở điều kiện tiêu chuẩn. Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp A.
Phương pháp giải
Gọi số mol của metan là x, số mol của etan là y
nA = 0,150 mol = x + y (1)
nCO2 = 0,20 mol = x + 2y (2)
Từ (1) và (2) → x = ?; y = ?
→ %VCH4 = ? và %VC2H6 = ?%
Hướng dẫn giải
Số mol hỗn hợp khí A là:
\({n_{hhA}} = \frac{{3,36}}{{22,4}} = 0,15(mol)\)
Gọi số mol của metan là x, số mol của etan là y
Vì số mol hỗn hợp là 0,15 mol nên ta có:
nA = x + y = 0,15 (1)
Bảo toàn nguyên tố Cacbon: (bạn cũng có thể sử dụng pthh)
nCO2 = x + 2y = 0,2 (2)
Từ (1) và (2) ta có hệ phương trình:
\(\begin{array}{l}
\left\{ {\begin{array}{*{20}{l}}
{x + y = 0,15}\\
{x + 2y = 0,2}
\end{array}} \right.\\
\to \left\{ {\begin{array}{*{20}{l}}
{x = 0,1(mol)}\\
{y = 0,05(mol)}
\end{array}} \right.
\end{array}\)
Thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp A là: (phần trăm thể tích cũng là phần trăm số mol nên dùng số mol để tính cũng được)
\(\begin{array}{*{20}{l}}
{\% {V_{C{H_4}}} = \frac{{0,1}}{{0,15}}.100 = 66,7}\\
{\% {V_{{C_2}{H_6}}} = 100 - 66,7 = 33,3}
\end{array}\)
4. Giải bài 4 trang 123 SGK Hóa học 11
Khi 1,00 g metan cháy tỏa ra 55,6 kJ. Cần đốt bao nhêu lít khí metan (đktc) để lượng nhiệt sinh ra đủ đun 1,00 lít nước (D = 1,00 g/cm3) từ 25,00C lên 100,0oC. Biết rằng muốn nâng 1,00g nước lên 1,0oC cần tiêu tốn 4,18J và giả sử nhiệt sinh ra chỉ dùng để làm tăng nhiệt độ của nước.
Phương pháp giải
- Tính khối lượng của 1 lít nước
- Tính nhiệt lượng 1000g nước thu vào để tăng 25oC đến 100oC
- Khối lượng metan cần đốt cháy = Nhiệt lượng 1000g nước thu vào: 55,6 → Số mol metan → V
Hướng dẫn giải
Khối lượng của 1,00 lit nước là:
m = D.V = 1,00.1000 = 1000g
Nhiệt lượng mà 1000 gam nước thu vào để tăng nhiệt độ từ 25oC đến 100oC là:
Q = 1000.4,18(100 - 25) = 313500(J) = 313,5 KJ
Đó là nhiệt lượng mà khí metan khi đốt cháy cần phải toả ra.
Khối lượng metan cần phải đốt cháy là:
\(m = \frac{{313,5}}{{55,6}} = \frac{{3135}}{{556}}\)
Số mol metan cần phải đốt cháy là:
\(n = \frac{m}{M} = \frac{{3135}}{{556.16}} = \frac{{3135}}{{8896}}\)
Vậy thể tích khí metan (đktc) cần phải đốt cháy là:
\(V = n.22,4 = \frac{{3135}}{{8896}}.22,4 \approx 7,89(l)\)
5. Giải bài 5 trang 123 SGK Hóa học 11
Khi cho pentan tác dụng với brom theo tỉ lệ 1:1, sản phẩm chính thu được là:
A. 2-brompentan
B. 1-brompentan
C. 1,3-đibrompentan
D. 2,3-đibrompentan
Phương pháp giải
Sản phẩm chính là sản phẩm mà clo thế vào cacbon có bậc cao nhất.
Hướng dẫn giải
Khi cho pentan tác dụng với brom theo tỉ lệ 1:1, sản phẩm chính thu được là 2-brompentan
Phương trình phản ứng:
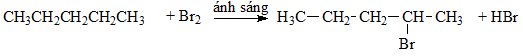
Gọi tên, ta đánh số mạch Cacbon chính:
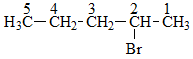
Nhánh: 2-brom
Mạch chính 5 cacbon
→ tên gọi: 2-brompentan
⇒ Đáp án A.
6. Giải bài 6 trang 123 SGK Hóa học 11
Đánh dấu Đ (đúng) hoặc S (sai) vào các ô trống cạnh các câu sau đây:
a) Ankan là hidrocacbon no, mạch hở.
b) Ankan có thể bị tách hidro thành anken.
c) Nung nóng ankan thu được hỗn hợp các ankan có phân tử khối nhỏ hơn.
d) Phản ứng của clo với ankan tạo thành ankyl clorua thuộc loại phản ứng thế.
e) Ankan có nhiều trong dầu mỏ.
Phương pháp giải
Để giải bài tập này cần nắm vững kiến thức về tính chất của ankan
Hướng dẫn giải
a) Đúng
b) Đúng
c) Sai. Khi đun nóng ankan xảy ra sự đứt gãy mạch cacbon còn tạo thành các hidrocacbon không no.
d) Đúng
e) Đúng
Tham khảo thêm
- doc Giải bài tập SGK Hóa 11 Bài 25: Ankan
- doc Giải bài tập SGK Hóa 11 Bài 26: Xicloankan



