Giải bài tập SGK Hóa 11 Bài 15: Cacbon
Nội dung hướng dẫn Giải bài tập Hóa 11 Bài 15 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về cacbon. Mời các em cùng theo dõi.
Mục lục nội dung

1. Giải bài 1 trang 70 SGK Hóa học 11
Tại sao hầu hết các hợp chất của cacbon lại là hợp chất cộng hóa trị?
Phương pháp giải
Để giải thích hầu hết các hợp chất của cacbon là hợp chất cộng hóa trị ta dựa vào electron lớp ngoài cùng và giá trị độ âm điện
Hướng dẫn giải
Hầu hết các hợp chất của cacbon lại là hợp chất cộng hóa trị vì nguyên tử cacbon có 4e ở lớp ngoài cùng (2s22p2), độ âm điện trung bình nên rất khó cho hoặc nhận electron mà chủ yếu liên kết được tạo thành từ việc dùng chung các electron với nguyên tử của các nguyên tố khác (liên kết cộng hóa trị).
2. Giải bài 2 trang 70 SGK Hóa học 11
Tính oxi hóa của cacbon thể hiện ở phản ứng nào trong các phản ứng sau?
1. C + O2 → CO2
2. C + 2CuO → 2Cu + CO2
3. 3C + 4 Al → Al4C3
4. C + H2O → CO + H2
Phương pháp giải
Để xác định tính oxi hóa của cacbon thể hiện ở phản ứng nào ta dựa vào số oxi hóa của cacbon trước và sau phản ứng.
Hướng dẫn giải
Tính oxi hóa của cacbon thể hiện ở phản ứng:
3C + 4 Al → Al4C3
Số oxi hóa của cacbon giảm từ 0 xuống -4
⇒ Chọn đáp án C.
3. Giải bài 3 trang 70 SGK Hóa học 11
Tính khử của cacbon thể hiện ở phản ứng nào trong các phản ứng sau?
A. 2C + Ca → CaC2
B. C + 2H2 → CH4
C. C + CO2 → 2CO
D. 3C + 4Al → Al4C3
Phương pháp giải
Để xác định tính khử của cacbon thể hiện ở phản ứng nào ta dựa vào số oxi hóa của cacbon trước và sau phản ứng.
Hướng dẫn giải
Tính khử của cacbon thể hiện ở phản ứng:
C + CO2 → 2CO
Số oxi hóa của cacbon tăng từ 0 lên +2
⇒ Chọn đáp án C.
4. Giải bài 4 trang 70 SGK Hóa học 11
Lập phương trình hóa học của các phản ứng sau đây:
a) H2SO4(đặc) + C → SO2 + CO2 + ?
b) HNO3(đặc) + C → NO2 + CO2 + ?
c) CaO + C → CaC2 + CO
d) SiO2+ C → Si + CO
Phương pháp giải
Đây đều là các phản ứng oxi hóa khử → ta dùng phương pháp cân bằng electron để cân bằng các phương trình trên.
Hướng dẫn giải
Câu a
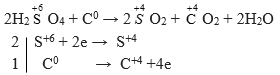
Câu b
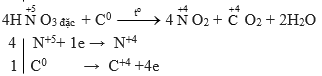
Câu c
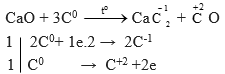
Câu d
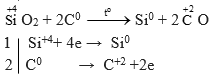
5. Giải bài 5 trang 70 SGK Hóa học 11
Đốt một mẫu than đá (chứa tạp chất không cháy) có khối lượng 0,6 kg trong oxi dư, thu được 1,06 m3 (đktc) khí cacbonic. Tính thành phần phần trăm khối lượng của cacbon trong mẫu than đá trên.
Phương pháp giải
Từ số mol CO2 ta dựa vào phương trình hóa học để tính mol cacbon → thành phần phần trăm khối lượng của cacbon trong mẫu than đá.
Hướng dẫn giải
nCO2 = 1060/22,4 = 47,3 (mol)
Ta có phương trình hóa học sau:
C + O2 → CO2
1,00 mol 1,00 mol
47,3 mol 47,3 (mol)
Phần trăm khối lượng của C trong mẫu than đá:
%mC = \(\frac{{47,3.12.100}}{{600}} = 94,6\% \)
Tham khảo thêm
- doc Giải bài tập SGK Hóa 11 Bài 16: Hợp chât của cacbon
- doc Giải bài tập SGK Hóa 11 Bài 17: Silic và hợp chất của silic
- doc Giải bài tập SGK Hóa 11 Bài 18: Công nghiệp silicat
- doc Giải bài tập SGK Hóa 11 Bài 19: Luyện tập: TCHH của cacbon, silic và hợp chất của chúng



