Giải bài tập SGK Hóa 11 Bài 39: Dẫn xuất halogen của hiđrocacbon
Để giúp các em có thể củng cố các kiến thức như: khái niệm, phân loại dẫn xuất halogen; Tính chất hóa học đặc trưng của một số dẫn xuất halogen; Hoạt tính sinh học và ứng dụng của một số dẫn xuất halogen... eLib xin giới thiệu tài liệu Giải bài tập SGK Hóa 11 Bài 39. Mời các em cùng tham khảo!
Mục lục nội dung

1. Giải bài 1 trang 177 SGK Hóa học 11
Gọi tên mỗi chất sau: CH3-CH2Cl, CH2=CH-CH2Cl, CHCl3. C6H5Cl. Viết phương trình hoá học của các phản ứng điều chế mỗi chất trên từ hiđrocacbon tương ứng.
Phương pháp giải
Để giải bài tập này cần nắm vững lý thuyết trọng tâm về hợp chất HX và phương pháp điều chế chúng.
Hướng dẫn giải
CH3- CH2Cl : etyl clorua (cloetan);
CH2 = CH- CH2Cl: anlyl clorua (1-cloprop- 2-en);
C6H5Cl : phenyl clorua (clobenzen)
CHCl3: clorofom (triclometan)
- Điều chế các chất trên từ hidrocacbon tương ứng:
CH3CH3 + Cl2 → CH3- CH2Cl + HCl
CH2=CH-CH3 + Cl2 → CH2 = CH- CH2Cl +HCl
CH4 + 3Cl2 → CHCl3 + 3HCl
C6H6 + Cl2 → C6H5Cl + HCl
2. Giải bài 2 trang 177 SGK Hóa học 11
Viết phương trình hoá học của phản ứng thuỷ phân các chất sau trong dung dịch NaOH: 1,2- đicloetan; benzylclorua; etyl bromua; xiclohexyl clorua.
Phương pháp giải
Xem lại lý thuyết tính chất hóa học của dẫn xuất halogen
Hướng dẫn giải
Cl-CH2-CH2-Cl + 2NaOH → OH-CH2-CH2-OH + 2NaCl
C6H5-CH2-Cl + NaOH → C6H5-CH2-OH + NaCl
CH2=CH-CH2-Br + NaOH → CH2=CH-CH2-OH + NaBr
C6H11-Cl + NaOH → C6H11-OH + NaCl
3. Giải bài 3 trang 177 SGK Hóa học 11
Cho nhiệt độ sôi (0C) của một số dẫn xuất halogen trong bảng dưới đây:
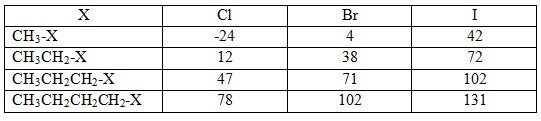
Nhận xét về sự biến đổi nhiệt độ sôi theo chiều tăng mạch cacbon (theo hàng dọc) và theo nguyên tử khối của halogen (hàng ngang). Giải thích sơ bộ.
Phương pháp giải
Phân tích mạch cacbon, nhiệt độ sôi của chất phụ thuộc vào phân tử khối của HX, từ đó rút ra nguyên nhân
Hướng dẫn giải
- Theo chiều ngang khi cùng mạch cacbon, các nguyên tử khối của các halogen tăng dần dẫn đến nhiệt độ sôi cũng tăng dần.
- Theo chiều dọc khi mạch cabon tăng (cùng nguyên tố halogen) thì nhiệt độ sôi của các chất cũng tăng dần.
Nguyên nhân là do: khi nguyên tử khối của các chất tăng dần cần tốn nhiều năng lượng để chuyển các phân tử hữu cơ sang trạng thái hơi nhiệt độ sôi tăng.
4. Giải bài 4 trang 177 SGK Hóa học 11
Từ axetilen, viết phương trình hóa học của các phản ứng điều chế: etyl bromua (1); 1,2- đibrometan (2); vinyl clorua (3); 1,1- đibrometan (4).
Phương pháp giải
(1) C2H2 → C2H6 → C2H5Br
(2) C2H2 → C2H4 → CH2Br- CH2Br
(3) C2H2 → C2H3Cl
(4) C2H2 →CH2=CHBr → CH3CHBr2
Hướng dẫn giải
(1) Điều chế etyl bromua
CH≡CH + H2 → C2H6
CH3-CH3 + Br2 → CH3-CH2-Br + HBr (đk: ánh sang)
(2) Điều chế 1,2-đibrometan
CH≡CH + H2 → CH2=CH2 (xt: Pb/PbCO3, to)
CH2=CH2 + Br2 → CH3Br – CH3Br
(3) Điều chế vinyl clorua
CH≡CH + HCl → CH2=CH-Cl (xt: HgCl2, 150oC-200oC)
(4) Điều chế 1,1 –đibrometan
CH≡CH + HBr → CH2=CHBr
CH2=CHBr + HBr → CH3CHBr2
5. Giải bài 5 trang 177 SGK Hóa học 11
Dùng hai ống nghiệm, mỗi ống đựng 1ml một trong hai chất lỏng sau: etylbromua (1); brombenzen (2).
Thêm tiếp vào mỗi ống 1 ml dung dịch AgNO3. Đun sôi hai ống nghiệm, thấy ở ống 1 có kết tủa vàng nhạt, trong khi đó ở ống 2 không có hiện tượng gì. Nhận xét và giải thích các hiện tượng ở thí nghiệm trên.
Phương pháp giải
Liên kết C-Br trong etylbromua kém bền hơn trong liên kết C-Br gắn trực tiếp vào vòng benzen.
Do vậy ở etylbromua có phản ứng tạo ra AgBr↓vàng còn brombezen thì không có phản ứng.
Hướng dẫn giải
Ống (1) có phản ứng:
CH3 – CH2Br + H2O → CH3- CH2OH + HBr
AgNO3 + HBr → AgBr↓vàng + HNO3
Ống (2) không có phản ứng
Nhận xét: Chứng tỏ liên kết C- Br trong brombenzen rất bền, liên kết C-Br trong etylbromua kém bền hơn.
6. Giải bài 6 trang 177 SGK Hóa học 11
Khi đun nóng etyl clorua trong dung dịch chứa KOH và C2H5OH, thu được
A. Etanol
B. Etilen
C. Axetilen
D. Etan
Phương pháp giải
Xem lại lý thuyết về dẫn xuất halogen
Hướng dẫn giải
CH3CH2-Cl + KOH → CH2=CH2 + KCl + H2O (xt: C2H5OH, to)
Đáp án B
Tham khảo thêm
- doc Giải bài tập SGK Hóa 11 Bài 40: Ancol
- doc Giải bài tập SGK Hóa 11 Bài 41: Phenol
- doc Giải bài tập SGK Hóa 11 Bài 42: Luyện tập Dẫn xuất halogen, ancol, phenol



