Giải bài tập SGK Hóa 11 Bài 7: Nitơ
Nội dung hướng dẫn Giải bài tập Hóa 11 Bài 7 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về nitơ. Mời các em cùng theo dõi.
Mục lục nội dung

1. Giải bài 1 trang 31 SGK Hóa học 11
Trình bày cấu tạo của phân tử N2. Vì sao ở điều kiện thường, nitơ là một chất trơ? Ở điều kiện nào nitơ trở nên hoạt động hơn?
Phương pháp giải
Để trả lời câu hỏi trên cần nắm rõ lý thuyết về nitơ.
Hướng dẫn giải
- Công thức cấu tạo của phân tử nitơ: N ≡ N
- Giữa hai nguyên tử trong phân tử N2 hình thành một liên kết ba bền vững. Mỗi nguyên tử nitơ trong phân tử N2 có 8e lớp ngoài cùng, trong đó có 3 cặp e dùng chung và 1 cặp e dùng riêng đã ghép đôi.
- Ở nhiệt độ cao (trên 3000°C), nitơ hoạt động hơn và có thể phản ứng với nhiều chất khác.
- Ở nhiệt độ cao nitơ trở nên hoạt động vì phân tử N2 phân huỷ thành nguyên tử nitơ có 5e lớp ngoài cùng và có độ âm điện tương đối lớn (3,04) nên trở nên hoạt động.
2. Giải bài 2 trang 31 SGK Hóa học 11
Nitơ không duy trì sự hô hấp, nitơ có phải là khí độc không?
Phương pháp giải
Để trả lời câu hỏi trên cần nắm rõ lý thuyết về nitơ.
Hướng dẫn giải
Nitơ không phải là khí độc mặc dù không duy trì sự hô hấp và sự cháy.
3. Giải bài 3 trang 31 SGK Hóa học 11
a) Cặp công thức của liti nitrua và nhôm nitrua là
A. LiN3 và Al3N.
B. Li3N và AlN.
C. Li2N3 và Al2N3.
D. Li3N2 và Al3N2.
b) Viết phương trình hóa học của phản ứng tạo thành liti nitrua và nhôm nitrua khi cho liti và nhôm tác dụng trực tiếp với nitơ. Trong các phản ứng này nitơ là chất oxi hóa hay chất khử?
Phương pháp giải
Để trả lời câu hỏi trên cần ghi nhớ:
a) Li có hóa trị I và Al có hóa trị III. Lập công thức hóa học của liti nitrua và nhôm nitrua theo quy tắc hóa trị đã được học ở lớp 8.
b) Ở nhiệt độ cao, nitơ tác dụng được với một số kim loại hoạt động tạo thành nitrua kim loại.
Hướng dẫn giải
Câu a
Cặp công thức của liti nitrua và nhôm nitrua là LiN3 và Al3N.
→ Đáp án đúng là B.
Câu b
Phương trình hóa học của phản ứng tạo thành liti nitrua và nhôm nitrua khi cho liti và nhôm tác dụng trực tiếp với nitơ:
6Li + N2 → 2Li3N
6Al + N2 → 2Al3N
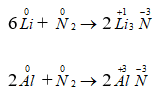
Ta thấy trong các phản ứng trên nitơ là chất oxi hoá vì 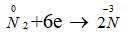
Do vậy trong các phản ứng trên nitơ là chất oxi hoá.
4. Giải bài 4 trang 31 SGK Hóa học 11
Nguyên tố nitơ có số oxi hóa là bao nhiêu trong các hợp chất sau: NO, NO2, NH3, NH4Cl, N2O, N2O3, N2O5, Mg3N2?
Phương pháp giải
Xác định số oxi hóa của nguyên tử nitơ bằng quy tắc sau:
Trong một phân tử, tổng số oxi hóa của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng 0.
Hướng dẫn giải
Số oxi hóa của nitơ trong các hợp chất lần lượt là:
+2; +4; -3; -3; +1; +3; +5; -3.
5. Giải bài 5 trang 31 SGK Hóa học 11
Cần lấy bao nhiêu lít khí nitơ và khí hiđro để điều chế được 67,2 lít khí amoniac? Biết rằng thể tích của các khí đều được đo trong cùng điều kiện nhiệt độ, áp suất và hiệu suất của phản ứng là 25%.
Phương pháp giải
- Bước 1: Viết phương trình hóa học
- Bước 2: Tính số mol khí hidro và nitơ theo mol khí amoniac.
- Bước 3: Tính thể tích các khí khi hiệu suất 25%.
Hướng dẫn giải
Phương trình hóa học của phản ứng:
3H2 + N2 ⇔ 2NH3
4,5 1,5 3 mol
Với hiệu suất 25%
Thể tích khí nitơ ở đktc là:
\({V_{{N_2}}} = 1,5.22,4.\frac{{100}}{{25}} = 134,4(l)\)
Thể tích khí hiđro là:
\({V_{{H_2}}} = 4,5.22,4.\frac{{100}}{{25}} = 403,2(l)\)
Tham khảo thêm
- doc Giải bài tập SGK Hóa 11 Bài 8: Amoniac và muối amoni
- doc Giải bài tập SGK Hóa 11 Bài 9: Axit nitric và muối nitrat
- doc Giải bài tập SGK Hóa 11 Bài 10: Photpho
- doc Giải bài tập SGK Hóa 11 Bài 11: Axit photphoric và muối photphat
- doc Giải bài tập SGK Hóa 11 Bài 12: Phân bón hóa học
- doc Giải bài tập SGK Hóa 11 Bài 13: Luyện tập: Tính chất của nitơ, photpho và hợp chất của chúng



