Hoá học 9 Bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Các nguyên tố được sắp xếp trong bảng tuần hoàn các nguyên tố hoá học. Vậy chúng được sắp xếp trong bảng tuần hoàn theo nguyên tắc nào? Quy luật biến đổi tính chất của chúng ra sao? Mối quan hệ giữa vị trí của nguyên tố trong bảng tuần hoàn với cấu tạo và tính chất của nguyên tố như nào? Chúng ta sẽ nghiên cứu trong bảng tuần hoàn các nguyên tố hoá học ngày hôm nay.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Nguyên tắc sắp xếp các nguyên tố
Các nguyên tố trong Bảng hệ thống tuần hoàn được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử
1.2. Cấu tạo bảng tuần hoàn
a. Ô nguyên tố
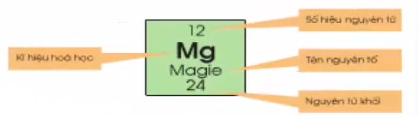
Ô nguyên tố cho biết: số hiệu nguyên tử, Kí hiệu hóa học, tên nguyên tố, nguyên tử khối của nguyên tố đó.
- Số hiệu nguyên tử có số trị bằng số đơn vị điện tích hạt nhân và bằng số electron trong nguyên tử, số hiệu nguyên tử trùng với số thứ tự của nguyên tố trong bảng tuần hoàn.
b. Chu kì
- Chu kì là dãy các nguyên tố mà nguyên tử của chúng được xếp theo chiều điện tích hạt nhân tăng dần.
- Gồm 7 chu kì, chu kì 1,2,3 được gọi là chu kì nhỏ, chu kì 4, 5, 6, 7 được gọi là chu kì lớn.
c. Nhóm
Nhóm gồm các nguyên tố mà nguyên tử của chúng có tính chất tương tự nhau được xếp thành cột theo chiều tăng của điện tích hạt nhân nguyên tử
1.3. Sự biến đổi tính chất của các nguyên tố
a. Trong một chu kì
Theo chiều tăng dần của điện tích hạt nhân.
Tính kim loại của các nguyên tố giảm dần , đồng thời tính phi kim tăng dần.
Ví dụ:
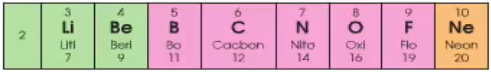
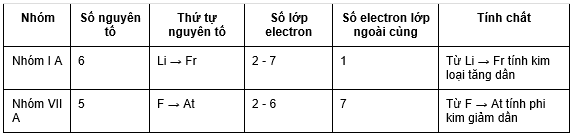
Số electron lớp ngoài cùng tăng từ 1 - 8
Đầu dãy là kim loại mạnh (Li), cuối chu kì là phi kim mạnh (F), kết thúc là khí hiếm (Ne)
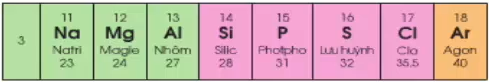
Số electron lớp ngoài cùng tăng từ 11 - 18
Đầu dãy là kim loại mạnh (Na), cuối chu kì là phi kim mạnh (Cl), kết thúc là khí hiếm (Ar)
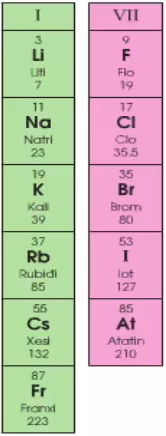
b. Trong một nhóm
Trong một nhóm: đi từ trên xuống theo chiều tăng điện tích hạt nhân. Tính kim loại của các nguyên tố tăng dần đồng thời tính phi kim các nguyên tố giảm dần.
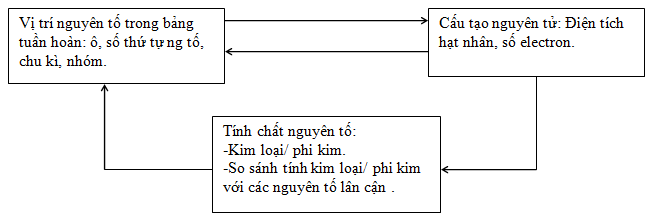
1.4. Ý nghĩa của bảng tuần hoàn
2. Bài tập minh họa
2.1. Dạng 1: Cấu tạo, tính chất nguyên tử
Cho nguyên tử A có số hiệu nguyên tử bằng 17, chu kì 3, nhóm VII
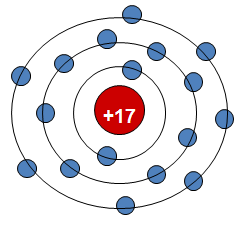
Hãy cho biết cấu tạo nguyên tử, tính chất của nguyên tố A và so sánh với các nguyên tố lân cận.
Hướng dẫn giải
- Số hiệu nguyên tử là 17 ⇒ Điện tích hạt nhân (17+) và có 17 electron.
- Chu kì 3, nhóm VII ⇒ có 3 lớp electron và 7 electron lớp ngoài cùng.
- Nguyên tử A ở cuối chi kì 3 nên là Phi kim hoạt động mạnh.
| ... | Nhóm VI | Nhóm VII |
| Chu kì 2 | F | |
| Chu kì 3 | S | Cl |
| Chu kì 4 | Br |
Từ vị trí của các nguyên tử ta nhận xét được như sau:
- Trong một chu kì: Tính phi kim tăng. Như vậy tính phi kim của Cl > tính phi kim của S.
- Trong một nhóm: Tính phi kim giảm. Như vậy so về tính phi kim thì F > Cl > Br.
2.2. Dạng 2: Xác định vị trí nguyên tử
Nguyên tử của nguyên tố X có điện tích hạt nhân là 16+, 3 lớp electron, lớp electron ngoài cùng có 6 electron. Hãy cho biết vị trí của X trong bảng tuần hoàn.
Hướng dẫn giải
Nguyên tử của nguyên tố X có điện tích hạt nhân là 16+, 3 lớp electron, lớp electron ngoài cùng có 6 electron nên X ở ô 16, chu kì 3, nhóm VI, là một phi kim vì đứng gần cuối chu kì 3 và gần đầu nhóm VI.
2.3. Dạng 3: Độ hoạt động hóa học
Hãy sắp xếp các nguyên tố sau theo chiều tính phi kim tăng dần: F, O, N, P, As. Giải thích.
Hướng dẫn giải
Chiều tính phi kim tăng từ: As, P, N, O, F.
Giải thích:
- N, P và As trong cùng một nhóm, mà điện tích hạt nhân của N < P < As nên tính phi kim của N > P > As
- N, O và F trong cùng một chu kì, mà điện tích hạt nhân của N < O < F nên tính phi kim của N < O < F
→ Theo tính chất bắc cầu, tính phi kim của As < P < N < O < F.
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Dựa vào bảng tuần hoàn các nguyên tố hoá học, hãy
a) So sánh mức độ hoạt động hoá học của Si, P, S, Cl.
b) So sánh mức độ hoạt động hoá học của Na, Mg, Al.
Câu 2: Hãy cho biết các sắp xếp nào sau đây đúng theo chiều tính kim loại giảm dần:
a) Na, Mg, Al, K.
b) K, Na, Mg, Al.
c) Al, K, Na, Mg.
d) Mg, K, Al, Na.
Giải thích sự lựa chọn.
Câu 3: Nguyên tố R tạo thành hợp chất khí với hiđro có công thức hoá học chung là RH4. Trong hợp chất có hoá trị cao nhất với oxi thì O chiếm 72,73% khối lượng.
a) Hãy xác định tên nguyên tố R.
b) Viết công thức hoá học các hợp chất của nguyên tố R với oxi và hiđro.
c) Cho biết vị trí của nguyên tố R trong bảng tuần hoàn.
3.2. Bài tập trắc nghiệm
Câu 1: Bảng tuần hoàn các nguyên tố hóa học
A. Chiều nguyên tử khối tăng dần.
B. Chiều điện tích hạt nhân tăng dần.
C. Tính kim loại tăng dần.
D. Tính phi kim tăng dần.
Câu 2: Số thứ tự chu kì trong bảng tuần hoàn cho biết:
A. Số thứ tự của nguyên tố.
B. Số electron lớp ngoài cùng.
C. Số hiệu nguyên tử.
D. Số lớp electron.
Câu 3: Số nhóm trong bảng tuần hoàn cho biết:
A. Số electron lớp ngoài cùng.
B. Số thứ tự của nguyên tố.
C. Số hiệu nguyên tử.
D. Số lớp electron.
Câu 4: dãy nào sau đây thể hiện mức độ hoạt động hóa học của kim loại tăng dần:
A. Be , Fe , Ca , Cu
B. Ca , K , Mg , Ag
C. Al , Zn , Co , Ca
D. Ni , Mg , Li , Fr
4. Kết luận
Sau bài học cần nắm:
- Ô nguyên tố, về chu kì và nhóm.
- Từ cấu tạo nguyên tử của một số nguyên tố điển hình (thuộc 20 nguyên tố đầu tiên) dự đoán vị trí và tính chất hoá học cơ bản của chúng và ngược lại.
- So sánh tính kim loại hoặc tính phi kim của một số nguyên tố cụ thể với các nguyên tố lân cận (trong số 20 nguyên tố đầu tiên).
Tham khảo thêm
- doc Hoá học 9 Bài 25: Tính chất của phi kim
- doc Hóa học 9 Bài 26: Clo
- doc Hóa học 9 Bài 27: Cacbon
- doc Hoá học 9 Bài 28: Các oxit của cacbon
- doc Hoá học 9 Bài 29: Axit cacbonic và muối cacbonat
- doc Hoá học 9 Bài 30: Silic và công nghiệp silicat
- doc Hoá học 9 Bài 32: Luyện tập chương 3
- doc Hoá học 9 Bài 33: Thực hành: Tính chất hóa học của phi kim và hợp chất của chúng



.PNG)
