Hóa học 9 Bài 10: Một số muối quan trọng
Ở bài học trước các em đã biết những tính chất hóa học của muối. Và chúng ta cũng đã biết trong thực tế hợp chất muối có rất nhiều. Bài học hôm nay các em sẽ được nghiên cứu hợp chất muối quan trọng là Natriclorua và Kali nitrat. Vậy các muối này có những tính chất gì và ứng dụng ra sao? Để hiểu được ta vào bài mới
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Muối natriclorua (NaCl = 58,5)
a. Trạng thái thiên nhiên
- Trong nước biển thành phần chủ yếu là NaCl. (1m3 nước biển chứa 27kg NaCl, 5kg MgCl2, 1kg CaSO4 và một số muối khác).
- Muối NaCl còn có trong các mỏ muối.
b. Cách khai thác
- Cho nước biển (mặn) bay hơi từ từ → Muối kết tinh.
- Đào hầm, đào giếng sâu qua các lớp đất đá → Đem muối mỏ nghiền nhỏ → Tinh chế để có muối sạch.

c. Ứng dụng
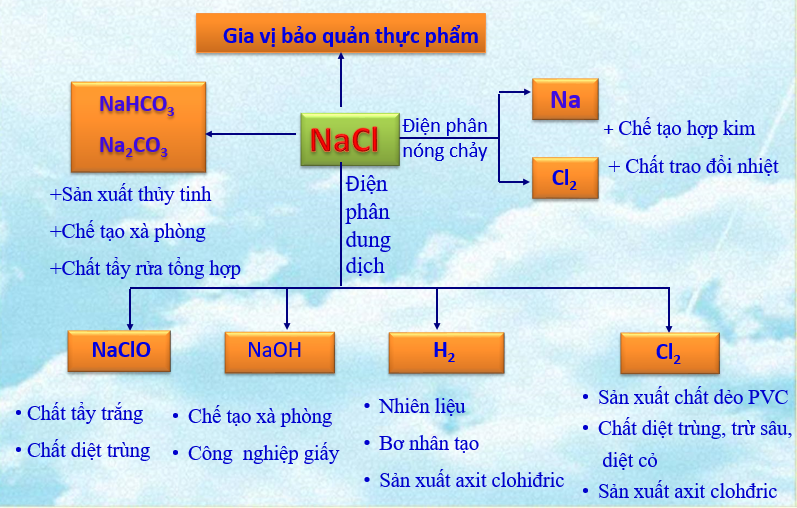
1.2. Muối kali nitrat (KNO3 = 101)
Kali nitrat còn có tên gọi khác là diêm tiêu, là chẩt rắn màu trắng
a. Tính chất
Muối KNO3 tan nhiều trong nước, bị phân hủy ở nhiệt độ cao. Muối KNO3 có tính chất ôxi hóa mạnh.
2KNO3 → 2KNO2 + O2
b. Ứng dụng
- Chế tạo thuốc nổ đen.
- Làm phân bón (cung cấp nguyên tố nitơ và kali cho cây trồng)
- Bảo quản thực phẩm trong công nghiệp.
2. Bài tập minh họa
2.1. Dạng 1: Viết phương trình hóa học
Viết các phương trình phản ứng hóa học theo sơ đồ sau:
Na2O → NaOH → Na2SO3 → SO2 → K2SO3
Hướng dẫn giải
Na2O + H2O → 2NaOH
SO2 + 2NaOH → Na2SO3 + H2O
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
SO2 + K2O → K2SO3
2.2. Dạng 2: Xác định thành phần phần trăm theo khối lượng của mỗi chất trong hỗn hợp
Hoà tan trong nước 0,325 g một hỗn hợp gồm 2 muối natriclorua và kaliclorua. Thêm vào dung dịch này một dung dịch bạc nitrat lấy dư. Kết tủa bạc clorua thu được có khối lượng là 0,717g. Tính thành phần phần trăm của mỗi chất trong hỗn hợp.
Hướng dẫn giải
Gọi mNaCl là x và mKCl là y ta có phương trình đại số:
x + y = 0,35 (1)
Phương trình hóa học:
NaCl + AgNO3 → AgCl + NaNO3
KCl + AgNO3 → AgCl + KNO3
Dựa vào 2 phương trình hóa học ta tìm được khối lượng của AgCl trong mỗi phản ứng:
m’AgCl = x . = x . = x . 2,444
mAgCl = y . = y . = y . 1,919
→ mAgCl = 2,444x + 1,919y = 0,717 (2)
Từ (1) và (2) → hệ phương trình:
\(\left\{ {\begin{array}{*{20}{l}}
{x + y = 0,325} \\
{2,444x + 1,919y = 0,717}
\end{array}} \right. \Rightarrow \left\{ {\begin{array}{*{20}{l}}
{x = 0,178} \\
{y = 0,147}
\end{array}} \right.\)
% NaCl = \(\frac{{0,178}}{{0,325}}\).100% = 54,76%
% KCl = 100% - % NaCl = 100% - 54,76% = 45,24%
Vậy trong hỗn hợp: NaCl chiếm 54,76%, KCl chiếm 45,24%
2.3. Dạng 3: Bài tập nhận biết
Có ba chất rắn màu trắng đựng trong 3 lọ riêng biệt không nhãn là: Na2CO3, NaCl, hỗn hợp NaCl và Na2CO3.
a) Hãy nhận biết chất đựng trong mỗi lọ bằng phương pháp hoá học.
b) Trình bày cách tiến hành và viết phương trình hoá học.
Hướng dẫn giải
- Dùng thuốc thử là dung dịch HNO3 loãng:
Ghi số thứ tự của 3 lọ, lấy một lượng nhỏ hoá chất trong mỗi lọ vào 3 ống nghiệm và ghi số thứ tự ứng với 3 lọ. Nhỏ dung dịch HNO3 cho đến dư vào mỗi ống, đun nóng nhẹ.
- Quan sát hiện tượng :
- Nếu không có hiện tượng gì xảy ra, chất rắn trong ống nghiệm là muối NaCl. Lọ cùng số thứ tự với ống nghiệm là NaCl.
- Nếu có bọt khí thoát ra thì chất rắn trong ống nghiệm có thể là Na2CO3 hoặc hỗn hợp Na2CO3 và NaCl.
- Lọc lấy nước lọc trong mỗi ống nghiệm đã ghi số rồi thử chúng bằng dung dịch AgNO3. Nếu :
+ Nước lọc của ống nghiệm nào không tạo thành kết tủa trắng với dung dịch AgNO3 thì muối ban đầu là Na2CO3.
+ Nước lọc của ống nghiệm nào tạo thành kết tủa trắng với dung dịch AgNO3 thì chất ban đầu là hỗn hợp hai muối NaCl và Na2CO3.
Các phương trình hoá học :
Na2CO3 + 2HNO3 → 2NaNO3 + H2O + CO2 ↑
(đun nóng nhẹ để đuổi hết khí CO2 ra khỏi dung dịch sau phản ứng)
NaCl + AgNO3 → AgCl ↓ + NaNO3
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Bằng phương pháp nhận biết hãy nhận biết các lọ mất nhãn:
a) K2SO4, NaCl, KNO3
b) Na2CO3, NaCl, CaCl2, AgNO3
Câu 2: Biết 5 gam hỗn hợp 2 muối là Na2CO3 và NaCl tác dựng vừa đủ với 20 ml dung dịch HCl, thu được 448 ml khí (đktc).
a) Tính nồng độ mol của dung dịch HCl đã dùng.
b) Tính khối lượng muối thu được sau phản ứng.
c) Tính thành phần phần trăm theo khối lượng của mỗi muối trong hỗn hợp ban đầu.
Câu 3: Dung dịch A có thể tích 100 ml chứa NaCl 0,5M. Dung dịch B có thể tích 200 ml chứa AgNO3 0,1M. Trộn dung dịch A với dung dịch B thu được dung dịch C và m gam chất kết tủa.
a. Tính m.
b. Tính nồng độ các chất có trong C.
3.2. Bài tập trắc nghiệm
Câu 1: Trong tự nhiên muối natri clorua có nhiều trong:
A. Nước biển.
B. Nước mưa.
C. Nước sông.
D. Nước giếng.
Câu 2: Nung kali nitrat (KNO3) ở nhiệt độ cao, ta thu được chất khí là:
A. NO
B. N2O
C. N2O5
D. O2
Câu 3: Điện phân dung dịch natri clorua (NaCl) bão hoà trong bình điện phân có màng ngăn ta thu được hỗn hợp khí là:
A. H2 và O2
B. H2 và Cl2
C. O2 và Cl2
D. Cl2 và HCl
4. Kết luận
Sau bài học cần nắm:
- Tính chất đặc trưng và ứng dụng của một số muối quan trọng (NaCl và KNO3).
- Vận dụng vào các bài tâp có liên quan.
Tham khảo thêm
- docx Hoá học 9 Bài 1: Tính chất hóa học của oxit và Khái quát về sự phân loại oxit
- docx Hóa học 9 Bài 2: Một số oxit quan trọng
- docx Hóa học 9 Bài 3: Tính chất hóa học của axit
- docx Hóa học 9 Bài 4: Một số axit quan trọng
- docx Hóa học 9 Bài 5: Luyện tập tính chất hóa học của oxit và axit
- docx Hóa học 9 Bài 6: Thực hành: Tính chất hóa học của oxit và axit
- docx Hóa học 9 Bài 7: Tính chất hóa học của bazơ
- docx Hóa học 9 Bài 8: Một số bazơ quan trọng
- docx Hóa học 9 Bài 9: Tính chất hóa học của muối
- docx Hóa học 9 Bài 11: Phân bón hóa học
- docx Hóa học 9 Bài 12: Mối quan hẹ giữa các loại hợp chất vô cơ
- docx Hóa học 9 Bài 13: Luyện tập chương 1 Các loại hợp chất vô cơ
- docx Hóa học 9 Bài 14: Thực hành: Tính chất hóa học của bazơ và muối



