Giải bài tập SGK Hóa 10 Bài 12: Liên kết ion - Tinh thể ion
Nhằm mục đích kiểm tra kiến thức về Liên kết ion - Tinh thể ion cũng như cách vận dụng tích chất để giải bài tập. eLib xin giới thiệu đến các em học sinh nội dung giải bài tập dưới đây. Với các bài tập có phương pháp và lời giải chi tiết, hi vọng rằng đây sẽ là tài liệu giúp các bạn học tập tốt hơn.
Mục lục nội dung

1. Giải bài 1 trang 59 SGK Hóa học 10
Liên kết hóa học trong NaCl được hình thành do
A. hai hạt nhân nguyên tử hút electron rất mạnh.
B. mỗi nguyên tử Na và Cl góp chung 1 electron.
C. mỗi nguyên tử đó nhường hoặc thu electron để trở thành các ion trái dấu hút nhau.
D. Na - e → Na+; Cl + e → Cl-; Na+ + Cl- → NaCl.
Chọn đáp án đúng nhất.
Phương pháp giải
Liên kết trong phân tử NaCl là liên kết ion, do vậy sự hình thành NaCl phải là sự cho nhận e của cation (Na+) và anion (Cl-)
Hướng dẫn giải
Liên kết hóa học trong NaCl được hình thành do
Na - e → Na+
Cl + e → Cl-
Na+ + Cl- → NaCl.
⇒ Đáp án đúng là D.
2. Giải bài 2 trang 59 SGK Hóa học 10
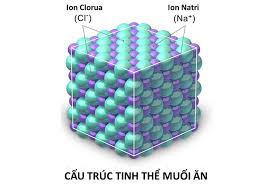
Muối ăn ở thể rắn là:
A. Các phân tử NaCl.
B. Các ion Na+ và Cl-.
C. Các tinh thể hình lập phương : các ion Na+ và Cl- được phân bố luân phiên đều đặn trên mỗi đỉnh.
D. Các tinh thể hình lập phương : các ion Na+ và Cl- được phân bố luân phiên đều đặn thành từng phân tử riêng rẽ.
Chọn đáp án đúng nhất.
Phương pháp giải
Quan sát hình sau và trả lời
Hướng dẫn giải
Muối ăn ở thể rắn là các tinh thể hình lập phương, các ion Na+ và Cl- được phân bố luân phiên đều đặn trên mỗi đỉnh.
⇒ Đáp án đúng là C.
3. Giải bài 3 trang 60 SGK Hóa học 10
a) Viết cấu hình electron của cation liti (Li+) và anion oxit (O2-)
b) Những điện tích ở ion Li+ , O2- do đâu mà có ?
c) Nguyên tử khí hiếm nào có cấu hình electron giống Li+ và nguyên tử khí hiếm có cấu hình electron giống O2-
d) Vì sao 1 nguyên tử oxi kết hợp được với 2 nguyên tử liti ?
Phương pháp giải
a) Viết cấu hình e của Li (Z =3) sau đó bỏ đi 1 e lớp ngoài sẽ ra được cấu hình e của Li+
Viết cấu hình e của O (Z =8) sau đó cộng thêm 2 e lớp ngoài sẽ ra được cấu hình e của O2-
b) Giải thích do sự nhường hoặc nhận e
c) Tính số e có của nguyên tử Li+, O2-
→ Số e khí hiếm nào bằng thì khí hiếm đó có cấu hình e giống
d) Dựa vào số OA lớp ngoài cùng để giải thích
Hướng dẫn giải
a) Cấu hình electron của:
Cation Li+: 1s2
Anion O2-: 1s22s22p6
b) Điện tích ở (Li+) do mất 1e mà có, điện tích ở (O2-) do nhận thêm 2e mà có
c) Nguyên tử khí hiếm He có cấu hình giống Li+
Nguyên tử khí hiếm Ne có cấu hình giống O2-
d) Vì mỗi nguyên tử liti chỉ có thể nhường 1 e, mà một nguyên tử oxi thu được 2e nên 1 nguyên tử oxi có thể kết hợp được với hai nguyên tử Li
2Li → 2Li+ + 2e
O + 2e → O2-
2Li+ + O2-→ Li2O
4. Giải bài 4 trang 60 SGK Hóa học 10
Xác định số proton, nơtron, electron trong các nguyên tử và ion sau:
\(\begin{array}{l}
a)\;_1^2{H^ + },\;_{18}^{40}Ar,\;_{17}^{35}C{l^ - },\;_{26}^{56}F{e^{2 + }}\\
b)\;_{20}^{40}C{a^{2 + }},\;_{16}^{32}{S^{2 - }},\;_{13}^{27}A{l^{3 + }}
\end{array}\)
Phương pháp giải
\({}_Z^AX\)
Với X là kí hiệu hóa học của nguyên tố
A là số khối
Z là số hiệu nguyên tử
Chú ý: số e = số p= số nguyên tử Z
số n = A - Z
Hướng dẫn giải
số p= số nguyên tử Z
số n = A - Z
a)
\({}_1^2{H^ + }\) có số p: 1 ; số e: 0; số n: 1
\({}_{18}^{40}Ar\) có số p: 18; số e: 18; số n: 22
\({}_{17}^{35}C{l^ - }\) có số p: 17; số e: 18; số n: 18
\({}_{26}^{56}F{e^{2 + }}\) có số p: 26; số e: 24; số n: 30
b)
\({}_{20}^{40}C{a^{2 + }}\) có số p: 20; số e: 18; số n: 20
\({}_{16}^{32}{S^{2 - }}\) có số p: 16; số e: 18; số n: 16
\({}_{13}^{27}A{l^{3 + }}\) có số p: 13; số e: 10; số n: 14
5. Giải bài 5 trang 60 SGK Hóa học 10
So sánh số electron trong các cation sau: Na+, Mg2+, Al3+
Phương pháp giải
+ Nhớ số hiệu nguyên tử của các nguyên tố Na, Mg, Al → số e tương ứng của các nguyên tố này
+ Lấy số e tương ứng của Na, Mg, Al trừ đi 1e, 2e, 3e là ra số e của các cation Na+, Mg2+, Al3+
Hướng dẫn giải
Vì ZNa = 11 → Na có 11e → Na+ có 11 - 1 = 10e
ZMg = 12 → Mg có 12e → Mg2+ có 12 – 2 = 10e
ZAl = 13 → Al có 13e → Al3+ có 13 – 3 = 10e
Các ion Na+, Mg2+, Al3+ đều có 10 electron
→ Số electron của các cation này bằng nhau
6. Giải bài 6 trang 60 SGK Hóa học 10
Trong các hợp chất sau đây, chất nào chứa ion đa nguyên tử, kể tên các ion đa nguyên tử đó:
a) H3PO4
b) NH4NO3
c) KCl
d) K2SO4
e) NH4Cl
f) Ca(OH)2
Phương pháp giải
Ion đa nguyên tử là ion được tạo nên từ 2 nguyên tố trở nên
Hướng dẫn giải
Các chất chứa ion đa nguyên tử là: H3PO4, NH4NO3, K2SO4, NH4Cl, Ca(OH)2
Tên các ion đa nguyên tử:
PO43-: anion photphat.
NH4+: cation amoni NH4+.
SO42-: anion sunfat.
OH-: anion hiđroxit.
NO3-: anion nitrat NO3-.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 10 Bài 13: Liên kết cộng hóa trị
- doc Giải bài tập SGK Hóa 10 Bài 14: Tinh thể nguyên tử và tinh thể phân tử
- doc Giải bài tập SGK Hóa 10 Bài 15: Hóa trị và số oxi hóa
- doc Giải bài tập SGK Hóa 10 Bài 16: Luyện tập Liên kết hóa học



