Giải bài tập SGK Hóa 10 Bài 22: Clo
Mời các em học sinh cùng tham khảo nội dung giải bài 22 SGK Hóa học 10 dưới đây. Tài liệu được biên soạn và tổng hợp với nội dung đầy đủ, chi tiết, hy vọng đây sẽ là tài liệu hữu ích giúp các em học tập thật tốt.
Mục lục nội dung

1. Giải bài 1 trang 101 SGK Hóa học 10
Trong phòng thí nghiệm, khí clo thường được điều chế bằng cách oxi hóa hợp chất nào sau đây?
A. NaCl
B. HCl
C. KClO3
D. KMnO4
Phương pháp giải
Xem lại lý thuyết về Clo, phương pháp điều chế Clo trong phòng thí nghiệm
Hướng dẫn giải
Trong phòng thí nghiệm, khí clo thường được điều chế bằng cách cho axit clohidric đặc (HCl) tác dụng với chất oxi hóa mạnh như mangan đioxit rắn (MnO2), kali pemanganat rắn (KMnO4)...
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
2. Giải bài 2 trang 101 SGK Hóa học 10
Cho biết tính chất hóa học cơ bản của nguyên tố clo. Giải thích vì sao nguyên tố clo có tính chất hóa học cơ bản đó. Cho ví dụ minh họa?
Phương pháp giải
Xem lại tính chất hóa học cơ bản của clo
- Tính oxi hóa mạnh
- Tác dụng với hidro
- Tác dụng vơi nước
Hướng dẫn giải
Clo có tính oxi hóa mạnh.
- Tác dụng với kim loại: clo oxi hóa trực tiếp hầu hết các kim loại tạo muối clorua, phản ứng xảy ra ở nhiệt độ thường hoặc không cao lắm, tốc độ nhanh, tỏa nhiều nhiệt.
2Fe + 3Cl2 → 2FeCl3
- Tác dụng với hiđro: Phản ứng xảy ra khi chiếu sáng mặt trời.
H2 + Cl2 → 2HCl
- Tác dụng với nước:
Cl2 + H2O → HCl + HClO
Nguyên tố clo có tính chất hóa học cơ bản đó vì khi tham gia phản ứng, nguyên tử clo dễ nhận thêm 1 electron để thành ion Cl-. Vì vậy tính chất hóa học cơ bản của clo là tính oxi hóa mạnh
3. Giải bài 3 trang 101 SGK Hóa học 10
Dẫn khí clo vào nước, xảy ra hiện tượng vật lí hay hóa học ? Giải thích.
Phương pháp giải
Hiện tượng vật lí: quá trình biến đổi không làm thay đổi tính chất chất của chất
Hiện tượng hóa học: hiện tượng tạo thành chất mới, khác tính chất của chất ban đầu.
Hướng dẫn giải
Dẫn khí clo vào nước, xảy ra vừa là hiện tượng vật lí , vừa là hiện tượng hóa học.
Khi hòa tan vào nước, một phần clo tác dụng với nước.
Cl2 + H2O ⇔ HCl + HClO
4. Giải bài 4 trang 101 SGK Hóa học 10
Nêu những ứng dụng thực tế của clo?
Phương pháp giải
Dựa vào kiến thức được học sách giáo khoa lớp 10 - trang 99 và những hiểu biết thực tế của bản thân để trả lời.
Hướng dẫn giải
Những ứng dụng thực tế của clo:
- Khí clo được dùng để tiệt trùng nước sinh hoạt, hòa tan vào nước một lượng nhỏ khí clo để diệt vi khuẩn gây bệnh.
- Khí clo được dùng để sản xuất các chất tẩy trắng sát trùng như nước Gia-ven, clorua vôi và sản xuất những hóa chất trong công nghiệp như HCl, KClO3
- Một lượng lớn clo được dùng để chế những dung môi công nghiệp như cacbon tetra clorua sản xuất nhiều chất polime như nhựa PVC, cao su tổng hợp…
5. Giải bài 5 trang 101 SGK Hóa học 10
Cân bằng phương trình hóa học của các phản ứng oxi hóa – khử sau bằng các phương pháp thăng bằng electron:
a) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
b) HNO3 + HCl → NO + Cl2 + H2O
c) HClO3 + HCl → Cl2 + H2O
d) PbO2 + HCl → PbCl2 + Cl2 + H2O
Phương pháp giải
- Bước 1: Xác định số oxi hóa của các nguyên tố trước và sau phản ứng để xác định được chất khử và chất oxi hóa
- Bước 2: viết các quá trình nhường e, nhận e
- Bước 3: tìm hệ số thích hợp cho chất khử và chất oxi hóa
- Bước 4: đặt các hệ số chất khử và chất oxi hóa vào sơ đồ phản ứng. hoàn thành phương trình hóa học.
Hướng dẫn giải
Cân bằng phương trình hóa học của các phản ứng oxi hóa – khử sau bằng các phương pháp thăng bằng electron:
a) 2\(\overset{+7}{KMnO_{4}}\)+ 16\(\overset{-1}{HCl}\)→ 2KCl + 2\(\overset{+2}{MnCl_{2}}\) + 5\(\overset{0}{Cl_{2}}\) + 8H2O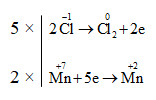
b) \(6\overset{-1}{HCl}\) + \(2\overset{+5}{HNO_{3}}\) → \(2\overset{+2}{NO}\) + 3\(\overset{0}{Cl_{2}}\) +4 H2O
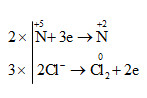
c) 5\(\overset{-1}{HCl}\) + \(\overset{+5}{HClO_{3}}\) → 3\(\overset{0}{Cl_{2}}\)+ 3H2O
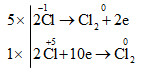
d) \(\overset{+4}{PbO_{2}}\) + 4\(\overset{-1}{HCl}\) → \(\overset{+2}{PbCl_{2}}\)+\(\overset{0}{Cl_{2}}\) + 2H2O
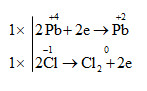
6. Giải bài 6 trang 101 SGK Hóa học 10
Tại sao trong công nghiệp người ta dùng phương pháp điện phân dung dịch NaCl bão hòa chứ không dùng phản ứng oxi hóa khử giữa các hóa chất để điều chế khí clo?
Phương pháp giải
Nắm vững phương pháp điều chế khí clo trong công nghiệp
Hướng dẫn giải
Trong công nghiệp không dùng phản ứng oxi hóa khử giữa các hóa chất để điều chế clo vì giá thành sản phẩm cao và NaCl có sẵn trong tự nhiên
7. Giải bài 7 trang 101 SGK Hóa học 10
Cần bao nhiêu gam KMnO4 vào bao nhiêu mililit dung dịch axit clohidric 1M để điều chế đủ khí clo tác dụng với sắt, tạo nên 16,25 g FeCl3 ?
Phương pháp giải
Tính số mol FeCl3 =? (mol)
Tính số mol Cl2 theo số mol của FeCl3
Viết PTHH HCl + KMnO4 →
Tính toán mol KMnO4 theo số mol của Cl2
Hướng dẫn giải
Phương trình hóa học của phản ứng:
3 Cl2 + 2Fe → 2FeCl3 (1)
0,15 0,1 (mol)
2KMnO4+16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O (2)
2 5 (mol)
0,06 0,48 0,15 (mol)
Theo phương trình (1): \({n_{C{l_2}}} = \dfrac{3}{2}{n_{F{\text{e}}C{l_3}}} = \dfrac{3}{2}.0,1 = 0,15\,\,mol\)
Theo phương trình (2): \({n_{KMn{O_4}}} = \dfrac{2}{5}{n_{C{l_2}}} = \dfrac{2}{5}.0,15 = 0,06\,\,mol\)
→ \(m_{KMnO_{4}cần}\) = 0,06 x 158 = 9,48g
Theo phương trình (2): \({n_{HCl}} = \dfrac{{16}}{5}{n_{C{l_2}}} = \dfrac{{16}}{5}.0,15 = 0,48\,\,mol\)
→ VddHCl = 0,48: 1 = 0,48 lít = 480 m
Tham khảo thêm
- doc Giải bài tập SGK Hóa 10 Bài 21: Khái quát về nhóm halogen
- doc Giải bài tập SGK Hóa 10 Bài 23: Hiđro clorua - Axit clohiđric và muối clorua
- doc Giải bài tập SGK Hóa 10 Bài 24: Sơ lược về hợp chất có oxi của clo
- doc Giải bài tập SGK Hóa 10 Bài 25: Flo - Brom - Iot
- doc Giải bài tập SGK Hóa 10 Bài 26: Luyện tập Nhóm halogen



