Giải bài tập SGK Hóa 10 Bài 32: Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit
Bài này sẽ giúp các em nắm vững được lý thuyết cũng như cách giải các bài tập của bài Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit với cách làm đầy đủ, chi tiết và rõ ràng. Hy vọng đây sẽ là tài liệu tham khảo hữu ích cho các em học sinh
Mục lục nội dung
1. Giải bài 1 trang 138 SGK Hóa học 10
2. Giải bài 2 trang 138 SGK Hóa học 10
3. Giải bài 3 trang 138 SGK Hóa học 10
4. Giải bài 4 trang 138 SGK Hóa học 10
5. Giải bài 5 trang 139 SGK Hóa học 10
6. Giải bài 6 trang 139 SGK Hóa học 10
7. Giải bài 7 trang 139 SGK Hóa học 10
8. Giải bài 8 trang 139 SGK Hóa học 10

1. Giải bài 1 trang 138 SGK Hóa học 10
Lưu huỳnh đioxit có thể tham gia các phản ứng sau :
SO2 + Br2 + 2H2O → 2HBr + H2SO4 (1)
SO2 + 2H2S → 3S + 2H2O (2)
Câu nào diễn tả không đúng tính chất hóa học của các chất trong những phản ứng trên ?
A. Phản ứng (1) : SO2 là chất khử, Br2 là chất oxi hóa.
B. Phản ứng (2) : SO2 là chất oxi hóa, H2S là chất khử.
C. Phản ứng (3) : SO2 vừa là chất khử, vừa là chất oxi hóa.
D. Phản ứng (1) : Br2 là chất oxi hóa, phản ứng (2) : H2S là chất khử.
Phương pháp giải
Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron.
Hướng dẫn giải
Phản ứng (1): SO2 là chất khử, Br2 là chất oxi hóa
Phản ứng (2): SO2 là chất oxi hóa, H2S là chất khử
Đáp án C
2. Giải bài 2 trang 138 SGK Hóa học 10
Hãy ghép cặp chất và tính chất sao cho phù hợp :
Các chất
A. S
B. SO2
C. H2S
D. H2SO4
Tính chất của chất
a) Chỉ có tính oxi hóa
b) Chỉ có tính khử
c) Có tính oxi hóa và tính khử.
d) Chất khí, có tính oxi hóa và tính khử
e) Không có tính oxi hóa và tính khử.
Phương pháp giải
Dựa vào tính chất hóa học của S, SO2, H2S và H2SO4 để đưa ra lựa chọn đúng
Hướng dẫn giải
S có tính oxi hóa và tính khử ⇒ A với c.
SO2 là chất khí có tính oxi hóa và tính khử ⇒ B với d.
H2S chỉ có tính khử ⇒ C với b.
H2SO4 chỉ có tính oxi hóa ⇒ D với a.
3. Giải bài 3 trang 138 SGK Hóa học 10
Cho phản ứng hóa học:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Câu nào sau đây diễn tả đúng tính chất các chất phản ứng ?
A. H2S là chất oxi hóa, Cl2 là chất khử.
B. H2S là chất khử, H2O là chất oxi hóa.
C. Cl2 là chất oxi hóa, H2O là chất khử.
D. Cl2 là chất oxi hóa, H2S là chất khử.
Phương pháp giải
Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron.
Hướng dẫn giải
Trong phản ứng:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Ta có:
\(\begin{array}{*{20}{l}}
{\mathop {{\rm{ }}S}\limits^{ - 2} \to \mathop {{\rm{ }}S}\limits^{ + 6} + 8e}\\
{\mathop {C{l_2}}\limits^0 + 2e \to 2\mathop {Cl}\limits^{ - 1} }
\end{array}\)
Chất phản ứng là Cl2 là chất oxi hóa, H2S là chất khử.
⇒ Đáp án D.
4. Giải bài 4 trang 138 SGK Hóa học 10
Hãy cho biết tính chất hóa học đặc trưng của
a) Hiđro sunfua.
b) Lưu huỳnh đioxit.
Dẫn ra những phản ứng hóa học để minh họa.
Phương pháp giải
Để giải bài tập này cần nắm vững các tính chất hóa học của Hiđro sunfua và Lưu huỳnh đioxit.
Hướng dẫn giải
a) Tính chất hóa học của hiđro sunfua:
- Hiđro sunfua tan trong nước thành dung dịch axit rất yếu.
- Tính khử mạnh :
H2S + O2 → 2S + 2H2O.
H2S + 3O2 → 2SO2 + 2H2O
b) Tính chất hóa học của lưu huỳnh đioxit
- Lưu huỳnh đioxit là một oxit axit :
+ SO2 tan trong nước thành dung dịch axit H2SO3, là axit yếu:
SO2 + H2O → H2SO3
+ SO2 tác dụng với dung dịch bazơ, tạo nên hai muối:
SO2 + NaOH → NaHSO3.
SO2 + 2NaOH → Na2SO3 + H2O.
- Lưu huỳnh đioxit là chất khử và là chất oxi hóa
SO2 + Br2 + 2H2O → 2HBr + H2SO4
SO2 + 2H2S → 3S + 2H2O.
5. Giải bài 5 trang 139 SGK Hóa học 10
Dẫn khí SO2 vào dung dịch KMnO4 màu tím nhận thấy dung dịch bị mất màu, vì xảy ra phản ứng hóa học sau :
SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4
a) Hãy cân bằng phương trình hóa học trên bằng phương pháp thăng bằng electron.
b) Hãy cho biết vai trò của SO2 và KMnO4 trong các trường hợp trên.
Phương pháp giải
Nắm được phương pháp cân bằng phản ứng oxi hóa khử bằng phương pháp thăng bằng electron.
Hướng dẫn giải
a)
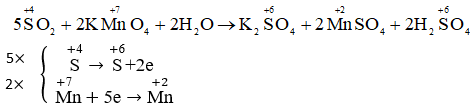
b) SO2 nhường e nên là chất khử, KMnO4 nhận e nên là chất oxi hóa.
6. Giải bài 6 trang 139 SGK Hóa học 10
a) Bằng phản ứng hóa học nào có thể chuyển hóa lưu huỳnh thành lưu huỳnh đioxit và ngược lại lưu huỳnh đioxit thành lưu huỳnh ?
b) Khí lưu huỳnh đioxit là khí chủ yếu gây mưa axit. Mưa axit phá hủy những công trình được xây dựng bằng đá, thép. Tính chất nào của SO2 đã hủy hoại những công trình này ? Hãy dẫn ra những phản ứng hóa học để chứng minh.
Phương pháp giải
Để giải bài tập này cần nắm vững các tính chất hóa học của Lưu huỳnh đioxit và Lưu huỳnh trioxit.
- Lưu ý tính khử của SO2, quá trình chuyển hóa SO2 → SO3 → H2SO4
Hướng dẫn giải
a) S + O2 → SO2 (dựa vào tính khử của S).
SO2 + 2H2S → 3S + 2H2O (dựa vào tính oxi hóa của SO2).
b) Tính khử của SO2.
SO2 do nhà máy thải vào khí quyển. Nhờ xúc tác là oxit kim loại trong khói bụi nhà máy, nó bị O2 của không khí oxi hóa thành SO3
2SO2 + O2 → 2SO3
SO3 tác dụng với nước mưa tạo thành mưa axit tạo ra H2SO4. Tính axit của H2SO4 đã phá hủy những công trình được xây dựng bằng đá (CaCO3), thép (Fe).
7. Giải bài 7 trang 139 SGK Hóa học 10
Hãy dẫn ra những phản ứng hóa học chứng minh rằng lưu huỳnh đioxit và lưu huỳnh trioxit là những oxit axit.
Phương pháp giải
Cần nêu được các phản ứng hóa học có đầy đủ tính chất của oxit axit, cụ thể như sau:
+ Tác dụng với nước
+ Tác dụng với bazơ, oxit bazơ
Hướng dẫn giải
SO2 và SO3 là các oxit axit vì:
- SO2 và SO3 tan trong nước tạo thành dung dịch axit tương ứng:
SO2 + H2O ⇔ H2SO3
SO3 + H2O → H2SO4
- SO2 và SO3 tác dụng với bazơ, oxit bazơ để tạo muối sunfit và sunfat:
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
SO3 + NaOH → NaHSO4
SO3 + 2NaOH → Na2SO4 + H2O.
SO2 + CaO → CaSO3
SO3 + MgO → MgSO4.
8. Giải bài 8 trang 139 SGK Hóa học 10
Cho hỗn hợp gồm Fe và FeS tác dụng với dung dịch HCl (dư), thu được 2,464 lít hỗn hợp khí (đktc). Cho hỗn hợp khí này đi qua dung dịch Pb(NO3)2 (dư) thu được 23,9 gam kết tủa màu đen.
a) Viết các phương trình hóa học của các phản ứng đã xảy ra.
b) Hỗn hợp khí thu được gồm những khí nào ? Thể tích mỗi khí là bao nhiêu (đktc) ?
c) Tính khối lượng của Fe và FeS trong hỗn hợp ban đầu.
Phương pháp giải
a) Viết PTHH các phản ứng xảy ra
b) Khí thu được gồm H2 và H2S
- Tính nPbS, n hỗn hợp khí = ?
n hỗn hợp khí = nH2 + nH2S → nH2 = n hỗn hợp khí - nH2S = ?
→ V = ?
c) nFe = nH2 = ? → mFe = ?
nFeS = nH2S = ? → mFeS = ?
Hướng dẫn giải
a) Phương trình hóa học của phản ứng:
(1) Fe + 2HCl → FeCl2 + H2
(2) FeS + 2HCl → FeCl2 + H2S
(3) H2S + Pb(NO3)2 → PbS↓ + 2HNO3
b) Khí thu được gồm H2 và H2S
Ta có: n↓ = nPbS = 23,9/239 = 0,1 mol; n hỗn hợp khí = 2,464/22,4 = 0,11 mol
Theo PTHH (3): nH2S = nPbS = 0,1 mol
Mặt khác: n hỗn hợp khí = nH2 + nH2S → nH2 = n hỗn hợp khí - nH2S = 0,11 – 0,1 = 0,01 mol
Vậy thể tích của mỗi khí là:
VH2 = 0,01.22,4 = 0,224 lít
VH2S = 0,1.22,4 = 2,24 lít
c) Theo PTHH (1): nFe = nH2 = 0,01 mol
Theo PTHH (2): nFeS = nH2S = 0,1 mol
Vậy khối lượng của mỗi chất trong hỗn hợp ban đầu là:
mFe = 0,01.56 = 0,56 gam
mFeS = 0,1.88 = 8,8 gam
9. Giải bài 9 trang 139 SGK Hóa học 10
Đốt cháy hoàn toàn 2,04 gam hợp chất A, thu được 1,08 g H2O và 1,344 l SO2 (đktc).
a) Hãy xác định công thức phân tử của hợp chất A.
b) Dẫn toàn bộ lượng hợp chất A nói trên qua dung dịch axit sunfuric đặc thấy có kết tủa màu vàng xuất hiện:
- Hãy giải thích hiện tượng và viết các phương trình phản ứng xảy ra.
- Tính khối lượng kết tủa thu được.
Phương pháp giải
a) Tính nSO2 → nS = nSO2 = ? → mS = ?
nH2O = ? → nH = 2nH2O = ? → mH = ?
Ta thấy: mS + mH = mA = 2,04 g
Như vậy hợp chất A chỉ gồm hai nguyên tố H và S.
→ Tỉ lệ số nguyên tử H và S = ?
b) 3H2S + H2SO4 → 4S + 4H2O
Do H2S có tính khử và H2SO4 có tính oxi hóa nên chúng có khả năng tác dụng với nhau sinh ra kết tủa vàng là S
nH2S = ? → nS = ? → mS = ?
Hướng dẫn giải
a) \(n_{SO_{2}}=\dfrac{1,344}{22,4}=0,06mol\) → nS = nSO2 = 0,06 mol → mS = 0,06.32 = 1,92 gam
\(n_{H_{2}O}=\dfrac{1,08}{18}=0,06mol\) → nH = 2nH2O = 0,12 mol → mH = 0,12.1 = 0,12 gam
Ta thấy: mS + mH = mA = 2,04 g
Như vậy hợp chất A chỉ gồm hai nguyên tố H và S.
Ta có tỉ lệ số nguyên tử H và S là: nH : nS = 0,12 : 0,06 = 2 : 1
Vậy công thức phân tử của A là H2S.
b) Phương trình hóa học của phản ứng:
3H2S + H2SO4 → 4S + 4H2O
0,06 → 0,08 (mol)
Do H2S có tính khử và H2SO4 có tính oxi hóa nên chúng có khả năng tác dụng với nhau sinh ra kết tủa vàng là S
\({n_{{H_2}S}} = \dfrac{{2,04}}{{34}} = 0,06\,\,mol\)
Theo phương trình: \({n_S} = \dfrac{4}{3}{n_{{H_2}S}} = \dfrac{4}{3}.0,06 = 0,08\,\,mol\)
Vậy mS = 0,08.32 = 2,56g.
10. Giải bài 10 trang 139 SGK Hóa học 10
Hấp thụ hoàn toàn 12,8g SO2 vào 250 ml dung dịch NaOH 1M.
a) Viết các phương trình hóa học của các phản ứng có thể xảy ra.
b) Tính khối lượng muối tạo thành sau phản ứng.
Phương pháp giải
Tính nSO2 = 0,2 mol, nNaOH = 0,25 mol
Viết PTHH của phản ứng → Ta nhận thấy \(1 < \dfrac{{{n_{NaOH}}}}{{{n_{S{O_2}}}}} = 1,25 < 2\)
Tạo hai muối
Gọi số mol của NaHSO3 và Na2SO3 lần lượt là x và y mol
\(\left\{ \begin{array}{l}
x + y = 0,2\\
x + 2y = 0,25
\end{array} \right. \to x = 0,15,y = 0,05\)
→ Khối lượng của mỗi muối sau phản ứng?
Hướng dẫn giải
\(n_{SO_{2}}=\dfrac{12,8}{64}=0,2\) (mol), \(n_{NaOH}=\dfrac{1.250}{1000}=0,25\) (mol).
a) Phương trình hóa học của phản ứng:
(1) SO2 + NaOH → NaHSO3
x x x (mol)
(2) SO2 + 2NaOH → Na2SO3 + H2O
y 2y y (mol)
Ta thấy: \(1 < \dfrac{{{n_{NaOH}}}}{{{n_{S{O_2}}}}} = 1,25 < 2\)
→ Xảy ra cả phương trình hóa học (1) và (2)
Gọi số mol của NaHSO3 và Na2SO3 lần lượt là x và y mol
Theo phương trình (1): \({n_{NaOH}} = {n_{NaH{\rm{S}}{O_3}}} = x\)mol
Theo phương trình (2): \({n_{NaOH}} = 2{n_{N{a_2}S{O_3}}} = 2y\)mol
\( \to {n_{NaOH}} = x + 2y = 0,25\)(*)
Theo phương trình (1): \({n_{S{O_2}}} = {n_{NaH{\rm{S}}{O_3}}} = x\)mol
Theo phương trình (2): \({n_{S{O_2}}} = {n_{N{a_2}S{O_3}}} = y\)mol
\( \to {n_{S{O_2}}} = x + y = 0,2\)(**)
Dựa vào (*) và (**) ta có hệ phương trình sau:
\(\left\{ \begin{array}{l}
x + y = 0,2\\
x + 2y = 0,25
\end{array} \right. \to x = 0,15,y = 0,05\)
Khối lượng của mỗi muối sau phản ứng là:
\(\begin{array}{l}
{m_{NaHS{O_3}}} = 0,15.104 = 15,6(g)\\
{m_{N{a_2}S{O_3}}} = 0,05.126 = 6,3(g)
\end{array}\)
Tham khảo thêm
- doc Giải bài tập SGK Hóa 10 Bài 29: Oxi - Ozon
- doc Giải bài tập SGK Hóa 10 Bài 30: Lưu huỳnh
- doc Giải bài tập SGK Hóa 10 Bài 33: Axit sunfuric, Muối sunfat
- doc Giải bài tập SGK Hóa 10 Bài 34: Luyện tập oxi và lưu huỳnh



