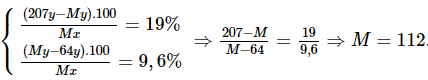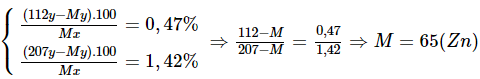Giải bài tập SGK Hóa 12 Nâng cao Bài 19: Kim loại và hợp kim
Hướng dẫn Giải bài tập Hóa học 12 nâng cao Bài 19 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về tính chất của kim loại và hợp kim. Mời các em cùng theo dõi.
Mục lục nội dung
1. Giải bài 1 trang 112 SGK Hóa 12 nâng cao
2. Giải bài 2 trang 112 SGK Hóa 12 nâng cao
3. Giải bài 3 trang 112 SGK Hóa 12 nâng cao
4. Giải bài 4 trang 112 SGK Hóa 12 nâng cao
5. Giải bài 5 trang 112 SGK Hóa 12 nâng cao
6. Giải bài 6 trang 112 SGK Hóa 12 nâng cao
7. Giải bài 7 trang 112 SGK Hóa 12 nâng cao
8. Giải bài 8 trang 112 SGK Hóa 12 nâng cao
9. Giải bài 9 trang 113 SGK Hóa 12 nâng cao
10. Giải bài 10 trang 113 SGK Hóa 12 nâng cao

1. Giải bài 1 trang 112 SGK Hóa 12 nâng cao
So với nguyên tử phi kim cùng một chu kì, nguyên tử kim loại:
A. Thường có bán kính nguyên tử nhỏ hơn.
B. Thường có năng lượng ion hóa nhỏ hơn.
C. Thường dễ nhận electron trong các phản ứng hóa học.
D. Thường có số electron ở phân lớp ngoài cùng nhiều hơn.
Phương pháp giải
Để lựa chọn đáp án phù hợp cần ghi nhớ: So với nguyên tử phi kim cùng một chu kì, nguyên tử kim loại thường có năng lượng ion hóa nhỏ hơn.
Hướng dẫn giải
So với nguyên tử phi kim cùng một chu kì, nguyên tử kim loại thường có năng lượng ion hóa nhỏ hơn.
⇒ Đáp án B.
2. Giải bài 2 trang 122 SGK Hóa 12 nâng cao
Cấu hình electron nào sau đây là của kim loại?
A. 1s22s22p63s23p4.
B. 1s22s22p63s23p5.
C. 1s22s22p63s1.
D. 1s22s22p6.
Phương pháp giải
Để lựa chọn đáp án phù hợp cần ghi nhớ đặc điểm electron lớp ngoài cùng của kim loại.
Hướng dẫn giải
Cấu hình electron của kim loại là: 1s22s22p63s1
⇒ Đáp án C.
3. Giải bài 3 trang 112 SGK Hóa 12 nâng cao
Phát biểu nào sau đây là phù hợp với tính chất hóa học chung của kim loại?
A. Kim loại có tính khử, nó bị khử thành ion âm.
B. Kim loại có tính oxi hóa, nó bị oxi hóa thành ion dương.
C. Kim loại có tính khử, nó bị oxi hóa thành ion dương.
D. Kim loại có tính oxi hóa, nó bị khử thành ion âm.
Phương pháp giải
Để lựa chọn đáp án phù hợp cần ghi nhớ tính chất hóa học chung của kim loại.
Hướng dẫn giải
Tính chất hóa học chung của kim loại là kim loại có tính khử, nó bị oxi hóa thành ion dương.
⇒ Đáp án C.
4. Giải bài 4 trang 112 SGK Hóa 12 nâng cao
Người ta nói rằng những chất vật lí chung của kim loại, như tính dẻo, tính dẫn điện, tính dẫn nhiệt, ánh kim chủ yếu là do những electron tự do trong kim loại gây ra. Đúng hay sai? Hãy giải thích.
Phương pháp giải
Để giải thích ý trên cần nắm rõ nguyên nhân gây nên tính chất vật lí chung của kim loại, như tính dẻo, tính dẫn điện, tính dẫn nhiệt, ánh kim.
Hướng dẫn giải
Những chất vật lí chung của kim loại, như tính dẻo, tính dẫn điện, tính dẫn nhiệt, ánh kim chủ yếu là do những electron tự do trong kim loại gây ra ⇒ Đúng.
- Tính dẻo: các lớp mạng tinh thể kim loại có thể trượt lên nhau, nhưng không tách rời nhau là nhờ các electron tự do đã liên kết các lớp mạng với nhau.
- Tính dẫn điện: nối hai đầu dây của kim loại với nguồn điện, các electron tự do có năng lượng lớn chuyển động từ cực âm đến cực dương.
- Tính dẫn nhiệt: đốt nóng một đầu dây kim loại ở vùng electron tự do có năng lượng lớn chuyển động đến vùng có nhiệt độ thấp hơn, truyền năng lượng cho những ion dương ở vùng có nhiệt độ thấp.
- Ánh kim: các electron tự do trong kim loại phản xạ những tia sáng có bước sóng mà mắt có thể nhìn thấy được.
5. Giải bài 5 trang 112 SGK Hóa 12 nâng cao
Cho biết vị trí của những nguyên tố kim loại trong bảng tuần hoàn. Vị trí của kim loại có tính khử mạnh nhất và vị trí của phi kim có tính oxi hóa mạnh nhất. Viết cấu hình electron lớp ngoài cùng của hai nguyên tố này.
Phương pháp giải
Để trả lời các câu hỏi trên cần nắm rõ dựa vào electron hóa trị để xác định vị trí của những nguyên tố kim loại trong bảng tuần hoàn. Đồng thời xác định tính tuần hoàn về tính khử và tính oxi hóa của kim loại và phi kim.
Hướng dẫn giải
Vị trí những nguyên tố kim loại trong bảng tuần hoàn:
- Nhóm IA và IIA (trừ H)
- Nhóm III A (trừ Bo)
- Một phần nhóm IVA, VA, VIA
- Các nhóm B
- Họ lantan và actini
Kim loại có tính khử mạnh nhất nằm bên trái, phía dưới của bảng tuần hoàn: Cs-6s1
Phi kim có tính oxi hóa mạnh nhất nằm phía trên bên phải của bảng tuần hoàn: F – 2s22p5
6. Giải bài 6 trang 112 SGK Hóa 12 nâng cao
Viết cấu hình electron nguyên tử của các nguyên tố kim loại Na, Mg, Ca, Fe và các ion của chúng Na+, Mg2+, Ca2+, Fe2+, Fe3+
Phương pháp giải
Để viết cấu hình electron cuả các cation kin loại cần nắm rõ số hiệu nguyên tử Z của các kim loại tương ứng để suy ra số electron của các cation kim loại.
Hướng dẫn giải
Cấu hình electron của các kim loại và ion của chúng là:
Na (Z = 11): 1s22s22p63s1
Mg (Z = 12): 1s22s22p63s2
Ca (Z = 20): 1s22s22p63s23p64s2
Fe (Z = 26): 1s22s22p63s23p63d64s2
Na+ (Z = 11): 1s22s22p6
Mg2+ (Z = 12): 1s22s22p6
Ca2+ (Z = 20): 1s22s22p63s23p6
Fe2+ (Z = 26): 1s22s22p63s23p63d6
Fe3+ (Z = 26): 1s22s22p63s23p63d5
7. Giải bài 7 trang 112 SGK Hóa 12 nâng cao
Cho một lá sắt nhỏ vào dung dịch một trong những muối sau: AlCl3, CuSO4, Pb(NO3)2, ZnCl2, NaNO3. Hãy cho biết:
a. Trường hợp nào xảy ra phản ứng? Vai trò của những chất tham gia?
b. Viết phương trình hóa học của phản ứng dưới dạng ion thu gọn.
Phương pháp giải
Để biết được trường hợp nào xảy ra phản ứng cần nắm rõ điều kiện tính chất hóa học của kim loai khi tác dụng muối.
Hướng dẫn giải
Câu a
- Các trường hợp xảy ra phản ứng:
Fe + CuSO4 → FeSO4 + Cu
Fe + Pb(NO3)2 → Fe(NO3)2 + Pb
- Vai trò của chất tham gia:
Fe là chất khử: Fe → Fe2+ + 2e
Cu2+, Pb2+ là chất oxi hóa:
Cu2+ + 2e → Cu
Pb2+ + 2e → Pb
Câu b
Phương trình hóa học của phản ứng dưới dạng ion thu gọn:
Fe + Cu2+ → Fe2+ + Cu
Fe + Pb2+ → Fe2+ + Pb
8. Giải bài 8 trang 112 SGK Hóa 12 nâng cao
Cho Cu tác dụng với dung dịch Fe2(SO4)3 thu được dung dịch hỗn hợp FeSO4 và CuSO4. Thêm một ít bột sắt vào dung dịch hỗn hợp, nhận thấy bột sắt bị hòa tan.
a. Viết phương trình hóa học của phản ứng xảy ra dưới dạng phân tử và dưới dạng ion thu gọn.
b. So sánh tính khử của các đơn chất kim loại và tính oxi hóa của các ion kim loại.
Phương pháp giải
Để viết phương trình hóa học của phản ứng xảy ra ta dựa vào dữ kiện chất tham gia và sản phẩm sau mỗi quá trình. Đồng thời, dựa vào phương trình và điều kiện của phản ứng kim loại tác dụng với muối để so sánh tính khử, tính oxi hóa.
Hướng dẫn giải
Câu a
Phương trình hóa học của phản ứng xảy ra dưới dạng phân tử và dưới dạng ion thu gọn:
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
Cu + 2Fe3+ → Cu2+ + 2Fe2+
Fe + CuSO4 → FeSO4 + Cu
Fe + Cu2+ → Fe2+ + Cu
Câu b
- Tính khử: Fe > Cu
- Tính oxi hóa: Fe2+ < Cu2+ < Fe3+
9. Giải bài 9 trang 113 SGK Hóa 12 nâng cao
Có những trường hợp sau:
a. Dung dịch FeSO4 lẫn tạp chất CuSO4. Hãy giới thiệu một phương pháp hóa học đơn giản có thể loại bỏ tạp chất. Giải thích và viết phương trình dạng phân tử và dạng ion thu gọn.
b. Bột Cu có lẫn tạp chất là bột Zn và bột Pb. Hãy giới thiệu một phương pháp hóa học đơn giản để loại bỏ những tạp chất. Giải thích và viết phương trình hóa học dạng phân tử và dạng ion thu gọn.
Phương pháp giải
Để lựa chọn phương pháp hóa học đơn giản có thể loại bỏ tạp chất ta cần dựa vào tính chất đặc trưng của mỗi chất để chọn chất tác dụng với chất cần loại bỏ. Từ đó, thu được chất cần làm sạch nhưng tuân theo nguyên tắc không thêm chất mới trong sản phẩm.
Hướng dẫn giải
Câu a: Dung dịch FeSO4 lẫn tạp chất CuSO4
- Cho Fe vào dung dịch FeSO4 có lẫn CuSO4, khuấy kĩ, lọc bỏ chất rắn gốm Cu và Fe dư ta được FeSO4 tinh khiết.
- Phương trình dạng phân tử:
Fe + CuSO4 → FeSO4 + Cu
- Phương trình dạng ion thu gọn:
Fe + Cu2+ → Fe2+ + Cu
Câu b: Bột Cu có lẫn tạp chất là bột Zn và bột Pb
- Hòa tan bột Cu lẫn Zn và Pb vào dung dịch Cu(NO3)2 khuấy để phản ứng xảy ra hoàn toàn, lọc lấy chất rắn là Cu tinh khiết.
- Phương trình dạng phân tử và ion thu gọn:
Zn + Cu(NO3)2 → Zn(NO3)2 + Cu
Zn + Cu2+ → Zn2+ + Cu
Pb + Cu(NO3)2 → Pb(NO3)2 + Cu
Pb + Cu2+ → Pb2+ + Cu
10. Giải bài 10 trang 113 SGK Hóa 12 nâng cao
Hãy giải thích về sự thay đổi của khối lượng lá Zn trong mỗi dung dịch sau :
a. CuSO4
b. CdCl2
c. AgNO3
d. NiSO4
Phương pháp giải
Để giải thích về sự thay đổi của khối lượng lá Zn trong mỗi dung dịch trên ta cần xét xem Zn có tác dụng với các chất đó hay không.
Hướng dẫn giải
Câu a: Sự thay đổi của khối lượng lá Zn trong CuSO4
Zn khử được ion Cu2+ trong dung dịch muối thành Cu tự do.
Zn + CuSO4 → ZnSO4 + Cu
Zn + Cu2+ → Zn2+ + Cu
Lượng Cu sinh ra bám lên thanh Zn nhỏ hơn lượng Zn tan (theo phương trình phản ứng 65 gam Zn tan đi được bù đắp lại 64 gam Cu) nên khối lượng thanh Zn sau phản ứng giảm.
Câu b: Sự thay đổi khối lượng lá Zn trong dung dịch CdCl2
Zn khử được ion Cd2+ trong dung dịch muối thành Cd tự do
Zn + CdCl2→ ZnCl2 + Cd
Zn + Cd2+ → Zn2+ + Cd
Lượng Cd sinh ra bám lên thanh Zn lớn hơn lượng Zn tan (theo phương trình phản ứng 65 gam Zn tan đi được bù đắp lại 112 gam Cd) nên khối lượng Zn sau phản ứng tăng.
Câu c: Sự thay đổi khối lượng lá Zn trong dung dịch AgNO3
Zn khử được ionAg+ trong dung dịch muối thành Ag tự do
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
Zn + 2Ag+ → Zn2+ + 2Ag
Lượng Ag sinh ra bám lên thanh Zn lớn hơn lượng Zn tan (theo phương trình phản ứng 65 gam Zn tan đi được bù đắp lại 108.2=216 gam Ag) nên khối lượng thanhZn sau phản ứng tăng.
Câu d: Sự thay đổi khối lượng lá Zn trong dung dịch NiSO4
Zn khử được ion Ni+ trong dung dịch muối thành Ni tự do
Zn + NiSO4 → ZnSO4 + Ni
Zn + Ni2+ → Zn2+ + Ni
Lượng Ni sinh ra bám lên thanh Zn nhỏ hơn lượng Zn tan ( theo phương trình phản ứng 65 gam Zn tan đi được bù đắp lại 59 gam Ni) nên khối lượng thanh Zn sau phản ứng giảm.
11. Giải bài 11 trang 113 SGK Hóa 12 nâng cao
Có hai lá kim loại, cùng chất cùng khối lượng, có khả năng bị oxi hóa số oxi hóa +2. Một lá được ngâm trong dung dịch Pb(NO3)2 và lá kia được ngâm trong dung dịch Cu(NO3)2. Sau một thời gian người ta lấy các lá kim loại ra khỏi dung dịch rửa nhẹ, làm khô. Nhận thấy lá kim loại ngâm trong muối chì tăng thêm 19%, khối lượng lá kim loại kia giảm 9,6%. Biết rằng trong hai phản ứng trên, khối lượng các kim loại bị hòa tan như nhau. Hãy xác định tên của hai lá kim loại đã dùng.
Phương pháp giải
- Bước 1: Đặt kí hiệu của kim loại là X, khối lượng nguyên tử của X là M có số mol là: x mol.
- Bước 2: Viết phương trình hóa học, lập hệ phương trình theo dữ kiện đề bài.
- Bước 3: Giải hệ phương trình, suy ra M, suy ra kim loại cần tìm.
Hướng dẫn giải
Đặt kí hiệu của kim loại là X, khối lượng nguyên tử của X là M có số mol là: x mol.
Giả sử X phản ứng hết y mol
X + Pb(NO3)2 → X(NO3)2 + Pb (1)
y y
X + Cu(NO3)2 → X(NO3)2 + Cu (2)
y y
Ta có hệ phương trình:
Vậy kim loại cần tìm là Cd.
12. Giải bài 12 trang 113 SGK Hóa 12 nâng cao
Hai lá kim loại cùng chất, có khối lượng bằng nhau. Một được ngâm vào dung dịch Cd(NO3)2, một được ngâm vào dung dịch Pb(NO3)2. Cả hai lá kim loại đều bị oxi hóa thành ion kim loại 2+. Sau một thời gian, lấy các lá kim loại ra khỏi dung dịch. Nhận thấy khối lượng lá kim loại được ngâm trong muối cađimi tăng thêm 0,47%; còn lá kia tăng thêm 1,42%. Biết khối lượng của hai lá kim loại tham gia phản ứng là như nhau. Hãy xác định tên của lá kim loại đã dùng.
Phương pháp giải
- Bước 1: Đặt kí hiệu của kim loại là X, khối lượng nguyên tử của X là M có số mol là: x mol.
- Bước 2: Viết phương trình hóa học, lập hệ phương trình theo dữ kiện đề bài.
- Bước 3: Giải hệ phương trình, suy ra M, suy ra kim loại cần tìm.
Hướng dẫn giải
Đặt ký hiệu của kim loại cần tìm là X, khối lượng nguyên tử của X là M , số mol ban đầu là x mol.
Giả sử X phản ứng hết y mol.
X + Cd(NO3)2 → X(NO3)2 + Cd (1)
y y
X + Pb(NO3)2 → X(NO3)2 + Cd (2)
y y
Ta có hệ phương trình:
Vậy kim loại X là Zn.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 20: Dãy điện hóa của kim loại
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 21: Luyện tập: Tính chất của kim loại
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 22: Sự điện phân
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 23: Sự ăn mòn kim loại
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 24: Điều chế kim loại
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 25: Luyện tập: Sự điện phân, sự ăn mòn kim loại, điều chế kim loại.