Giải bài tập SGK Hóa 12 Nâng cao Bài 31: Một số hợp chất quan trọng của kim loại kiềm thổ
Hướng dẫn Giải bài tập Hóa học 12 nâng cao Bài 31 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về tính chất của một số hợp chất quan trọng của kim loại kiềm thổ. Mời các em cùng theo dõi.
Mục lục nội dung
1. Giải bài 1 trang 167 SGK Hóa 12 nâng cao
2. Giải bài 2 trang 167 SGK Hóa 12 nâng cao
3. Giải bài 3 trang 167 SGK Hóa 12 nâng cao
4. Giải bài 4 trang 167 SGK Hóa 12 nâng cao
5. Giải bài 5 trang 167 SGK Hóa 12 nâng cao
6. Giải bài 6 trang 167 SGK Hóa 12 nâng cao
7. Giải bài 7 trang 167 SGK Hóa 12 nâng cao
8. Giải bài 8 trang 168 SGK Hóa 12 nâng cao
9. Giải bài 9 trang 168 SGK Hóa 12 nâng cao
10. Giải bài 10 trang 168 SGK Hóa 12 nâng cao

1. Giải bài 1 trang 167 SGK Hóa 12 nâng cao
Chất nào sau đây không bị thủy phân khi nung nóng?
A. Mg(NO3)2
B. CaCO3
C. CaSO4
D. Mg(OH)2
Phương pháp giải
Để lựa chọn đáp án phù hợp cần xét xem các chất trên có tạo ra sản phẩm mới khi nung nóng hay không.
Hướng dẫn giải
Chất không bị thủy phân khi nung nóng là CaSO4.
⇒ Đáp án C.
2. Giải bài 2 trang 167 SGK Hóa 12 nâng cao
Theo thuyết Bron-stet, ion nào sau đây (trong dung dịch) có tính lưỡng tính?
A. CO32-
B. OH-
C. Ca2+
D. HCO3-
Phương pháp giải
Để lựa chọn đáp án phù hợp cần xét xem các ion trên có khả năng nhường nhận proton H+ hay không.
Hướng dẫn giải
HCO3- + OH- → CO32- + H2O
HCO3- + H+ → H2O + CO2
→ HCO3- có tính lưỡng tính.
→ Đáp án D.
3. Giải bài 3 trang 167 SGK Hóa 12 nâng cao
Nước tự nhiên có chứa ion nào dưới đây được gọi là nước có tính cứng tạm thời?
A. Ca2+, Mg2+, Cl-
B. Ca2+, Mg2+, SO42-
C. Cl-, SO42-, HCO3-, Ca2+
D. HCO3-, Ca2+, Mg2+
Phương pháp giải
Để lựa chọn đáp án phù hợp cần ghi nhớ: Nước tự nhiên có chứa ion HCO3-, Ca2+, Mg2+ được gọi là nước có tính cứng tạm thời.
Hướng dẫn giải
Nước tự nhiên có chứa ion HCO3-, Ca2+, Mg2+ được gọi là nước có tính cứng tạm thời.
⇒ Đáp án D.
4. Giải bài 4 trang 167 SGK Hóa 12 nâng cao
Một loại nước cứng khi đun sôi thì mất tính cứng, trong loại nước cứng này có hòa tan những chất nào sau đây?
A. Ca(HCO3)2, MgCl2
B. Ca(HCO3)2, Mg(HCO3)2
C. Mg(HCO3)2, CaCl2
D. MgCl2, Ca2SO4
Phương pháp giải
Để một loại nước mất tính cứng khi đun sôi thì trong loại nước cứng này có hòa tan những chất: Ca(HCO3)2, Mg(HCO3)2
Hướng dẫn giải
Một loại nước cứng khi đun sôi thì mất tính cứng, trong loại nước cứng này có hòa tan những chất: Ca(HCO3)2, Mg(HCO3)2
⇒ Đáp án B.
5. Giải bài 5 trang 167 SGK Hóa 12 nâng cao
Cho các chất:
A. NaCl
B. Ca(OH)2
C. Na2CO3
D. HCl
E. BaCl2
F. Na2SO4
Những chất nào có thể:
a. Làm mềm nước có tính cứng tạm thời.
b. Làm mềm nước có tính cứng vĩnh cửu.
Viết phương trình hóa học.
Phương pháp giải
- Để làm mềm nước cứng tạm thời có thể dùng Ca(OH)2 hoặc Na2CO3 do chúng làm kết tủa Ca2+ và Mg2+ dưới dạng muối cacbonat.
- Để làm mềm nước cứng vĩnh cửu có thể dùng Na2CO3
Hướng dẫn giải
Câu a
Để làm mềm nước cứng tạm thời có thể dùng Ca(OH)2 hoặc Na2CO3 do chúng làm kết tủa Ca2+ và Mg2+ dưới dạng muối cacbonat theo các phương trình:
- Ca(OH)2
OH- + HCO3- → CO32- + H2O
CO32- + Mg2+ → MgCO3\(^{\downarrow}\)
CO32- + Ca2+ → CaCO3\(^{\downarrow}\)
- Na2CO3
CO32- + Mg2+ → MgCO3\(^{\downarrow}\)
CO32- + Ca2+ → CaCO3\(^{\downarrow}\)
⇒ Dùng chất B hoặc C.
Câu b
Chất có thể làm mềm nước cứng vĩnh cửu: Na2CO3
CO32- + Mg2+ → MgCO3\(^{\downarrow}\)
CO32- + Ca2+ → CaCO3\(^{\downarrow}\)
⇒ Dùng chất C.
6. Giải bài 6 trang 167 SGK Hóa 12 nâng cao
a. Có 4 chất rắn đựng trong 4 lọ riêng biệt: Na2CO3, CaCO3, Na2SO4, CaSO4.2H2O. Bằng cách nào để nhận biết 4 chất, nếu ta chỉ dùng nước và dung dịch axit.
b. Có 3 chất rắn đựng trong 3 lọ riêng biệt: NaCl, CaCl2 và MgCl2. Hãy trình bày phương pháp hóa học để nhận biết mỗi chất (có đủ dụng cụ và những hóa chất cần thiết).
Phương pháp giải
Để nhận biết các chất trên cần nắm rõ tính chất hóa học đặc trưng của các chất đó để lựa chọn hóa chất và phương pháp phù hợp.
Hướng dẫn giải
Câu a: Phương pháp hóa học nhận biết Na2CO3, CaCO3, Na2SO4, CaSO4.2H2O nếu ta chỉ dùng nước và dung dịch axit
- Hòa tan 4 chất vào nước ta thu được hai nhóm:
+ Nhóm tan nhiều trong nước có Na2CO3 và Na2SO4
+ Nhóm ít tan trong nước có CaCO3 và CaSO4.H2O
- Nhỏ dung dịch HCl vào từng chất thuộc hai nhóm trên:
+ Nhận ra Na2CO3 vì có khí thoát ra còn Na2SO4 thì không
Na2CO3 + 2HCl → 2NaCl + CO2\(^{\downarrow}\) + H2O
+ Nhận ra CaCO3 vì có khí còn CaSO4.2H2O thì không
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Câu b
Lấy mỗi lọ một chất rắn đem hào tan vào nước, đánh số rồi chia làm hai phần:
- Phần 1: Nhỏ từ từ dung dịch NaOH vào, nhận ra ống đựng MgCl2 vì có kết tủa
2NaOH + MgCl2 → Mg(OH)2 + 2NaCl
- Phần 2: Loại bỏ ống nghiệm MgCl2 đã nhận ra, nhỏ từ từ dung dịch Na2CO3 vào nhận ra ống đựng CaCl2 vì có kết tủa
CaCl2 + Na2CO3 → CaCO3 + 2NaCl
Còn lại là NaCl
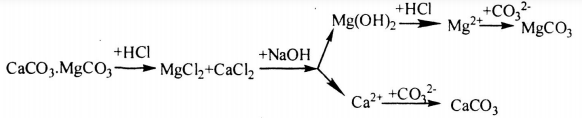
7. Giải bài 7 trang 167 SGK Hóa 12 nâng cao
Trong tự nhiên các nguyên tố magie và canxi có trong quặng đôlômit: CaCO3.MgCO3. Từ quặng này hãy trình bày phương pháp điều chế:
a. Hai chất riêng biệt là CaCO3 và MgCO3
b. Hai kim loại riêng biệt là Ca và Mg
Viết các phương trình hóa học.
Phương pháp giải
Để xác định phương pháp điều chế các chất trên cần dùng hóa chất thích hợp để tách riêng 2 muối trên dưới dạng kết tủa, sau đó cho tác dụng với hóa chất để biến đổi về chất cần điều chế.
Hướng dẫn giải
Câu a: Phương pháp điều chế CaCO3 và MgCO3
Sơ đồ điều chế như sau:
- Cho quặng hòa tan vào dung dịch HCl:
CaCO3 + 2HCl → CaCl2 + CO2 + 2H2O
MgCO3 + 2HCl → MgCl2 + CO2 + 2H2O
- Cho MgCl2 tác dụng với dung dịch NaOH để tạo kết tủa:
MgCl2 + 2NaOH → Mg(OH)2 ↓ + 2NaCl
- Lọc tách phần không tan thì dung dịch còn chứa các ion Ca2+, Cl-, Na+, OH- thêm Na2CO3 vào dung dịch ta thu CaCO3 kết tủa.
Ca2+ + CO32- → CaCO3
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
MgCl2 + Na2CO3 → MgCO3 + 2NaCl
Câu b: Phương pháp điều chế hai kim loại Ca và Mg
Làm tương tự như phần a để tách riêng 2 muối. Sau đó điện phân nóng chảy các dung dịch muối:
Phương trình hóa học:
CaCO3 + 2HCl → CaCl2 + CO2 + 2H2O
CaCl2 \(\xrightarrow{{dpnc}}\) Ca + Cl2
MgCl2 \(\xrightarrow{{dpnc}}\) Mg + Cl2
8. Giải bài 8 trang 168 SGK Hóa 12 nâng cao
Dựa vào bảng tính tan của một số hợp chất kim loại kiềm thổ (xem phần tư liệu), hãv xét xem phản ứng nào sau đây xảy ra:
Mg(OH)2 + Ca2+ → Ca(OH)2 + Mg2+.
Ca(OH)2 + Mg2+ → Mg(OH)2 + Ca2+
Phương pháp giải
Để trả lời câu hỏi trên cần dựa vào bảng tính tan của một số hợp chất kim loại kiềm thổ.
Hướng dẫn giải
Dựa vào bảng tính tan của kim loại kiềm thổ, phản ứng xảy ra là :
Ca(OH)2 + Mg2+ → Mg(OH)2 + Ca2+
Phản ứng này xảy ra vì điều kiện trao đổi ion Ca(OH)2 tan trong H2O độ tan 16.10−4 mol/100g H2O.
9. Giải bài 9 trang 168 SGK Hóa 12 nâng cao
Cho 10 lít (đktc) hỗn hợp khí gồm N2 và CO2 tác dụng với 2 lít dung dịch Ca(OH)2 0,02 mol/l, thu được 1 gam chất kết tủa. Hãy xác định thành phần % theo thể tích của mỗi khí trong hỗn hợp ban đầu?
Phương pháp giải
- Bước 1: Viết phương trình hóa học, tính số mol kết tủa và Ca(OH)2
- Bước 2: Xét 2 trường hợp CO2 dư và không dư. Suy ra thể tích của mỗi khí trong hỗn hợp ban đầu.
Hướng dẫn giải
Phương trình hóa học:
CO2 + Ca(OH)2 → CaCO3↓ + H2O (1)
Nếu dư CO2 dư : CO2 + CaCO3 + H2O → Ca(HCO3)2 (2)
- Trường hợp 1 : Nếu CO2 không dư :
nCO2 = nCaCO3 = 1 / 100 = 0,01 mol ⇒ VCO2 = 0,01 . 22,4 = 0,224 (lít)
⇒ %VCO2 = (0,224 / 10) . 100% = 2,24%
%VN2 = 100% – 2,24% = 97,76%
- Trường hợp 2 : Nếu CO2 dư:
nCa(OH)2 = 2 . 0,02 = 0,04 mol
Theo (1) nCO2 = nCa(OH)2 = nCaCO3 = 0,04 mol
Theo đề: nkết tủa = 0,01 mol ⇒ có 0,03 mol kết tủa bị hòa tan
nCO2 = nCaCO3 tan ra = 0,03 mol
nCO2 = 0,04 + 0,03 = 0,07 mol
⇒ VCO2 = 0,07 . 22,4 = 1,568 lít
⇒ %VCO2 = (1,568 / 10) . 100% = 15,68%
%VN2 = 100% – 15,68% = 84,32%
Vậy phần trăm theo thể tích mỗi khí CO2 và N2 lần lượt là 2,24% và 97,76% (nếu CO2 hết) và 15,68% và 84,32% (nếu CO2 dư).
10. Giải bài 10 trang 168 SGK Hóa 12 nâng cao
Có ba cốc đựng lần lượt: nước mưa, nước có tính cứng tạm thời, nước có tính cứng vĩnh cửu. Hãy nhận biết nước đựng trong mỗi cốc bằng phương pháp hóa học. Viết phương trình hóa học.
Phương pháp giải
- Bước 1: Đun nóng 3 cốc, cốc có kết tủa xuất hiện là cốc có chứa nước cứng tạm thời
- Bước 2: Nhỏ dung dịch Na2CO3 vào hai mẫu nước còn lại, cốc có kết tủa xuất hiện là cốc nước cứng vĩnh cửu.
Hướng dẫn giải
Cách nhận biết nước đựng trong mỗi cốc bằng phương pháp hóa học:
- Đun nóng 3 cốc, cốc có kết tủa xuất hiện là cốc có chứa nước cứng tạm thời:
Ca(HCO3)2 → CO2 + CaCO3 + H2O
Mg(HCO3)2 → CO2 + MgCO3 + H2O
- Nhỏ dung dịch Na2CO3 vào hai mẫu nước còn lại, cốc có kết tủa xuất hiện là cốc nước cứng vĩnh cửu:
CO32- + Mg2+ → MgCO3 ↓
CO32- + Ca2+ → CaCO3 ↓
- Còn lại là nước mưa (nước mềm).
11. Giải bài 11 trang 168 SGK Hóa 12 nâng cao
Cần dùng bao nhiêu gam Na2CO3 vừa đủ để làm mềm lượng nước cứng, biết lượng CaSO4 có trong nước cứng trên là 6.10-5 mol.
Phương pháp giải
Dựa vào phương trình hóa học và nCaSO4 để tính khối lượng Na2CO3.
Hướng dẫn giải
Ta có phương trình hóa học:
Na2CO3 + CaSO4 → Na2SO4 + CaCO3
nNa2CO3 = nCaSO4 = 6.10-5 mol
mNa2CO3 = 6.10-5 . 106 = 6,36 . 10-3 gam.
12. Giải bài 12 trang 168 SGK Hóa 12 nâng cao
Tính tổng khối lượng theo mg/lit của các ion Ca2+ và Mg2+ có trong một loại nước tự nhiên. Biết rằng nước này có chứa đồng thời các muối Ca(HCO3)2, Mg(HCO3)2 và CaSO4 với khối lượng tương ứng là 112,5 mg/l, 119 mg/l và 54,5 mg/l.
Phương pháp giải
Bảo toàn nguyên tố suy ra khối lượng của các cation.
Hướng dẫn giải
Ta có:
Ca(HCO3)2 → Ca2+
162 gam 40 gam
112,5 mg → 27,778 mg
Mg(HCO3)2 → Mg2+
146 gam 24 gam
11,9 mg → 1,956 mg
CaSO4 → Ca2+
136 gam 40 gam
54,5 mg 16,03 mg
Tổng khối lượng Ca2+ và Mg2+: 27,778 + 1,956 + 16,03 = 45,76 mg.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 28: Kim loại kiềm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 29: Một số hợp chất quan trọng của kim loại kiềm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 30: Kim loại kiềm thổ
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 32: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 33: Nhôm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 34: Một số hợp chất quan trong của nhôm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 35: Luyện tập: Tính chất của nhôm và hợp chất của nhôm