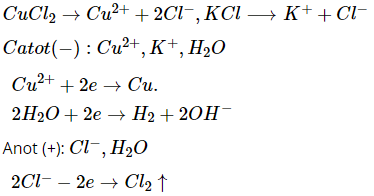Giải bài tập SGK Hóa 12 Nâng cao Bài 25: Luyện tập: Sự điện phân, sự ăn mòn kim loại, điều chế kim loại.
Hướng dẫn Giải bài tập Hóa học 12 nâng cao Bài 25 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về sự điện phân, sự ăn mòn kim loại, điều chế kim loại. Mời các em cùng theo dõi.
Mục lục nội dung

1. Giải bài 1 trang 142 SGK Hóa 12 nâng cao
Trong quá trình điện phân dung dịch Pb(NO3)2 với các điện cực trơ, ion Pb2+ di chuyển về
A. Catot và bị oxi hóa.
B. Anot và bị oxi hóa.
C. Catot và bị khử.
D. Anot và bị khử.
Phương pháp giải
Để lựa chọn đáp án phù hợp cần ghi nhớ:
Trong quá trình điện phân dung dịch Pb(NO3)2 với các điện cực trơ, ion Pb2+ di chuyển về catot và bị khử.
Hướng dẫn giải
Trong quá trình điện phân dung dịch Pb(NO3)2 với các điện cực trơ, ion Pb2+ di chuyển về catot và bị khử.
⇒ Đáp án C.
2. Giải bài 2 trang 142 SGK Hóa 12 nâng cao
Phát biểu nào sau đây không đúng?
A. Ăn mòn kim loại là sự phá hủy kim loại và hợp kim dưới tác dụng của môi trường xung quanh.
B. Ăn mòn kim loại là một quá trình hóa học trong đó kim loại bị ăn mòn bởi các axit trong môi trường không khí.
C. Trong quá trình ăn mòn, kim loại bị oxi hóa thành ion của nó.
D. Ăn mòn kim loại được chia làm 2 dạng: ăn mòn hóa học và ăn mòn điện hóa học.
Phương pháp giải
Để lựa chọn đáp án phù hợp cần ghi nhớ bản chất của ăn mòn kim loại.
Hướng dẫn giải
Phát biểu không đúng:
Ăn mòn kim loại là một quá trình hóa học trong đó kim loại bị ăn mòn bởi các axit trong môi trường không khí.
⇒ Đáp án B.
3. Giải bài 3 trang 143 SGK Hóa 12 nâng cao
Phản ứng điều chế kim loại nào dưới đây thuộc phương pháp nhiệt luyện:
A. C + ZnO → Zn + CO
B. Al2O3 → 2Al + 3/2O2
C. MgCl2 → Mg + Cl2
D. Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
Phương pháp giải
Để lựa chọn đáp án phù hợp cần nắm rõ bản chất của phương pháp nhiệt luyện.
Hướng dẫn giải
Phản ứng điều chế kim loại thuộc phương pháp nhiệt luyện là:
C + ZnO → Zn + CO
⇒ Đáp án A.
4. Giải bài 4 trang 143 SGK Hóa 12 nâng cao
Từ MgCO3 điều chế Mg. Từ CuS điều chế Cu. Từ K2SO4 điều chế K (các chất trung gian tùy ý chọn). Hãy viết các phương trình hóa học.
Phương pháp giải
Để viết phương trình hóa học điều chế các kim loại trên cần nắm rõ phương pháp điều chế kim loại từ các chất đã cho.
Hướng dẫn giải
- Từ MgCO3 điều chế Mg:
MgCO3 + 2HCl → MgCl2 + CO2 + H2O
MgCl2 \({\xrightarrow{{dpnc}}}\) Mg + Cl2
- Từ CuS điều chế Cu:
2CuS + 3O2 \(\xrightarrow{{{t^o}}}\) 2CuO + 2SO2
H2 + CuO \(\xrightarrow{{{t^o}}}\) Cu + H2O
- Từ K2SO4 điều chế K:
K2SO4 + BaCl2 → BaSO4↓ + 2KCl
2KCl \({\xrightarrow{{dpnc}}}\) 2K + Cl2
5. Giải bài 5 trang 143 SGK Hóa 12 nâng cao
Khi nung 23,2 gam sunfua của một kim loại hóa trị hai trong không khí rồi làm nguội sản phẩm thu được một chất lỏng và một chất khí. Lượng sản phẩm khí này làm mất màu 25,4 gam iot. Xác định tên của kim loại đó.
Phương pháp giải
- Bước 1: Gọi kim loại hóa trị II là M, viết phương trình hóa học.
- Bước 2: Bảo toàn nguyên tố lưu huỳnh, suy ra kim loai M.
Hướng dẫn giải
Gọi kim loại hóa trị II là M
⇒ Muối là MS nung trong không khí thu được một chất là SO2 và một chất lỏng.
SO2 phản ứng với I2 theo phương trình:
SO2 + I2 + 2H2O → H2SO4 + 2HI
Bảo toàn nguyên tố S ta có:
\(\begin{array}{*{20}{l}}
{{n_{S{O_2}}} = {n_{{I_2}}} = {n_{MS}} = \frac{{25,4}}{{254}} = 0,1\;mol}\\
\begin{array}{l}
\Rightarrow {M_{MS}} = \frac{{23,2}}{{0,1}} = 232 = M + 32\\
\Rightarrow M = 200
\end{array}
\end{array}\)
⇒ M là thủy ngân Hg.
6. Giải bài 6 trang 143 SGK Hóa 12 nâng cao
Điện phân 100 ml một dung dịch có hòa tan 13,5 gam CuCl2 và 14,9 gam KCl (có màng ngăn và điện cực trơ)
a) Trình bày sơ đồ và viết phương trình hóa học của phản ứng điện phân có thể xảy ra.
b) Hãy cho biết chất nào còn lại trong dung dịch điện phân. Biết thời gian điện phân là 2 giờ, cường độ dòng điện 5,1 ampe.
c) Hãy xác định nồng độ các chất có trong dung dịch sau điện phân. Biết rằng dung dịch sau điện phân đã được pha loãng cho đủ 200 ml.
Phương pháp giải
- Bước 1: Từ số mol muối suy ra mol nCl- ; nCu2+
- Bước 2: Viết sơ đồ điện phân, phương trình điện phân.
- Bước 3: Tính số mol chất còn lại sau điện phân.
- Bước 4: Nồng độ của các chất trong dung dịch sau điện phân.
Hướng dẫn giải
Câu a
nCuCl2 = 13,5 / 135 = 0,1 mol ; nKCl = 14,9 / 74,5 = 0,2 mol ⇒ nCl- = 0,4 mol; nCu2+ = 0,1 mol
Sơ đồ điện phân:
Phương trình điện phân :
CuCl2 → Cu + Cl2
2KCl + 2H2O → 2KOH + H2 + Cl2
Câu b
Khối lượng clo thoát ra m = (71 . 5,1 . 7200) / (2 . 96500) = 13,5 gam
⇒ nCl = 0,19 mol ⇒ Cl- còn dư
Hết Cu2+: 2H2O + 2e → H2 + 2OH- (dd)
Chất còn lại sau điện phân là K+ 0,2 mol; Cl- dư 0,02 mol; OH- dư 0,18 mol
⇒ KOH 0,18 mol; KCl 0,02 mol.
Câu c
Nồng độ của các chất trong dung dịch sau điện phân:
CM KOH = 0,18 / 0,2 = 0,9 M.
CM KCl = 0,02 / 0,2 = 0,1M.
7. Giải bài 7 trang 143 SGK Hóa 12 nâng cao
Thực hiện sự điện phân dung dịch CuSO4 với một điện cực bằng graphit và một điện cực bằng đồng.
Thí nghiệm 1: Người ta nối điện cực graphit với cực dương và điện cực đồng nối với cực âm của nguồn điện.
Thí nghiệm 2: Đảo lại, người ta nối điện cực graphit với cực âm và điện cực đồng rồi với cực dương của nguồn điện.
a) Hãy mô tả hiện tượng quan sát được và cho biết phản ứng xảy ra ở mỗi điện cực trong các thí nghiệm trên.
b) Hãy so sánh độ pH của dung dịch trong hai thí nghiệm trên.
c) Hãy so sánh nồng độ ion Cu2+ trong dung dịch sau hai thí nghiệm.
Phương pháp giải
a) Dựa vào dữ kiện đề bài để mô tả hiện tượng quan sát được và phản ứng xảy ra ở mỗi điện cực.
b) Dựa vào sự hình thành H+ để so sánh độ pH của dung dịch trong hai thí nghiệm trên.
c) Dựa vào phương trình điện phân để so sánh nồng độ ion Cu2+ trong dung dịch sau hai thí nghiệm.
Hướng dẫn giải
Câu a
Thí nghiệm 1:
Catot Cu (-) : Cu2+, H2O Anot graphit: SO42-, H2O
Cu2+ + 2e → Cu 2H2O → O2 + 4H+ + 4e
- Phương trình điện phân:
2Cu2+ + 2H2O \(\xrightarrow{{dp{\text{dd}}}}\) 2Cu + 4H+ + O2
- Hiện tượng :
- Kim loại đồng bám vào catot bằng đồng.
- Có khí thoát ra ở anot bằng graphit.
- Màu xanh của dung dịch nhạt dần.
Thí nghiệm 2 :
Catot graphit (-) : Cu2+, H2O Anot Cu: SO42-, H2O
Cu2+ + 2e → Cu catot Cuanot→ Cu2+ + 2e
- Phương trình điện phân:
Cu2+ (dd) + Cu anot → Cu catot + Cu2+ dd
- Hiện tượng :
- Kim loại đồng bám vào catot bằng graphit.
- Anot bằng đồng tan ra.
- Màu xanh của dung dịch không đổi.
Câu b
- Thí nghiệm 1: pH giảm (nồng độ H+ tăng)
- Thí nghiệm 2: pH không đổi
Nồng độ H+ ở thí nghiệm 1 lớn hơn thí nghiệm 2 ⇒ pH TN1 < pH TN2
Câu c
- Thí nghiệm 1: Nồng độ Cu2+ sau điện phân giảm.
- Thí nghiệm 2: Nồng độ Cu2+ không thay đổi trong quá trình điện phân.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 19: Kim loại và hợp kim
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 20: Dãy điện hóa của kim loại
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 21: Luyện tập: Tính chất của kim loại
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 22: Sự điện phân
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 23: Sự ăn mòn kim loại
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 24: Điều chế kim loại