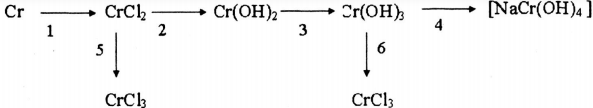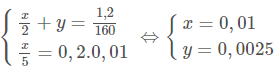Giải bài tập SGK Hóa 12 Nâng cao Bài 45: Luyện tập: Tính chất của crom, sắt và những hợp chất của chúng
Hướng dẫn Giải bài tập Hóa học 12 nâng cao Bài 45 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về tính chất của crom, sắt và những hợp chất của chúng. Mời các em cùng theo dõi.
Mục lục nội dung
1. Giải bài 1 trang 222 SGK Hóa 12 nâng cao
2. Giải bài 2 trang 222 SGK Hóa 12 nâng cao
3. Giải bài 3 trang 222 SGK Hóa 12 nâng cao
4. Giải bài 4 trang 222 SGK Hóa 12 nâng cao
5. Giải bài 5 trang 222 SGK Hóa 12 nâng cao
6. Giải bài 6 trang 223 SGK Hóa 12 nâng cao
7. Giải bài 7 trang 223 SGK Hóa 12 nâng cao

1. Giải bài 1 trang 222 SGK Hóa 12 nâng cao
Cho phương trình hóa học: 2Cr + 3Sn2+ → 2Cr3+ + 3Sn
Câu nào diễn tả đúng vai trò các chất?
A. Cr là chất oxi hóa, Sn2+ là chất khử
B. Cr là chất khử, Sn2+ là chất oxi hóa
C. Sn2+ là chất khử, Cr3+ là chất oxi hóa
D. Cr3+ là chất khử, Zn2+ là chất oxi hóa
Phương pháp giải
Cần dựa vào sự thay đổi số oxi hóa của các chất để chọn đáp án đúng.
Hướng dẫn giải
Câu diễn tả đúng vai trò các chất:
- Cr có số oxi hóa từ 0 tăng lên +3 là chất khử.
- Sn2+ có số oxi hóa giảm từ +2 xuống 0 là chất oxi hóa.
⇒ Đáp án B.
2. Giải bài 2 trang 222 SGK Hóa 12 nâng cao
Kim loại trong cặp oxi hóa khử nào sau đây có thể phản ứng với ion Ni2+ trong Ni2+/Ni?
A. Pb2+/Pb
B. Cu2+/Cu
C. Sn2+/Sn
D. Cr3+/Cr
Phương pháp giải
Để chọn đáp án đúng cần nhắm rõ dãy điện hóa của kim loại.
Hướng dẫn giải
Kim loại Cr3+/Cr trong cặp oxi hóa khử có thể phản ứng với ion Ni2+ trong Ni2+/Ni.
⇒ Đáp án D.
3. Giải bài 3 trang 222 SGK Hóa 12 nâng cao
Trong phản ứng Fe + H2SO4 \(\xrightarrow[ \ ]{ \ t^0 }\) Fe2(SO4)3 + H2O + SO2 có bao nhiêu nguyên tử Fe bị oxi hóa và bao nhiêu nguyên tử H2SO4 bị khử?
A. 2 và 3
B. 1 và 1
C. 3 và 2
D. 2 và 6
Phương pháp giải
Cần cân bằng phương trình trên bằng phương pháp thăng bằng electron, dựa vào hệ số cân bằng để chọn đáp án đúng.
Hướng dẫn giải
\(\mathop {2Fe}\limits^0 + 6{H_2}\mathop {{\text{ }}S}\limits^{ + 6} {O_4}\mathop \to \limits^{{t^0}} \mathop {F{e_2}}\limits^{ + 3} {(S{O_4})_3} + 3\mathop {{\text{ }}S}\limits^{ + 4} {O_2} + 6{H_2}O\)
\(\begin{array}{*{20}{c}} {2 \times }\\ {}\\ {3 \times } \end{array}\left| \begin{array}{l} \mathop {Fe}\limits^0 \to \mathop {Fe}\limits^{ + 3} + 3e\\ \mathop S\limits^{ + 6} + 2e \to \mathop S\limits^{ + 4} \end{array} \right.\)
Trong phản ứng có 2 nguyên tử Fe bị oxi hóa và 3 nguyên tử H2SO4 bị khử.
⇒ Đáp án A.
4. Giải bài 4 trang 222 SGK Hóa 12 nâng cao
Viết phương trình hóa học cho những chuyển đổi sau:
Phương pháp giải
Cần dựa vào chất đầu và chất cuối ở mỗi phương trình để suy ra những chất còn lại, từ đó viết phương trình hóa học.
Hướng dẫn giải
Các phương trình phản ứng như sau:
1) Cr + 2HCl → 2CrCl2 + H2
2) CrCl2 + 2NaOH \(\xrightarrow{{{t^o}}}\)Cr(OH)2 + 2NaCl
3) 4Cr(OH)2 + 2H2O + O2 → 4Cr(OH)3
4) Cr(OH)3 + NaOH → Na[Cr(OH)4]
5) 2CrCl2 + Cl2 \(\xrightarrow{{{t^o}}}\)2CrCl3
6) Cr(OH)3 + 3HCl → CrCl3 + 3H2O
5. Giải bài 5 trang 222 SGK Hóa 12 nâng cao
ăn mòn sắt, thép là một quá trình oxi hóa – khử.
a. Giải thích và viết phương trình hóa học của phản ứng xảy ra khi sắt thép bị ăn mòn.
b. Kẽm hoặc thiếc tráng ngoài vật bằng sắt, thép có tác dụng bảo vệ chống ăn mòn. Hãy giải thích một thực tế là sau một thời gian sử dụng thì vật được tráng bằng kẽm lại có hiệu quả bảo vệ tốt hơn
c. Vì sao thiếc lại được dùng nhiều hơn kẽm để bảo vệ những đồ hộp đựng thực phẩm. Còn lại kẽm lại được dùng nhiều hơn để bảo vệ ống dẫn nước, xô, chậu...?
Phương pháp giải
Để giải thích các câu hỏi trên cần nắm rõ tính chất hóa học của sắt, kẽm, thiếc.
Hướng dẫn giải
Câu a
Sự ăn mòn sắt thép là quá trình ăn mòn điện hóa với anot bị ăn mòn là sắt, catot là cacbon
Tại anot:
Fe → Fe2+ + 2e
Fe2+→ Fe3+ + e
Tại catot: 2H2O + 2e → 2OH- + H2
Sau đó Fe2+ + 2OH-→ Fe(OH)2
Fe3+ + 3OH- → Fe(OH)3
Fe(OH)2, Fe (OH)3 → Fe2O3.nH2O (gỉ sắt)
Câu b
Tráng kẽm, thiếc ngoài vật bằng sắt, thép thì kẽm có hiệu quả bảo vệ tốt hơn do:
- Kẽm là kim loại có tính khử mạnh hơn sắt, nếu xảy ra hiện tượng ăn mòn thì kẽm bị ăn mòn trước.
- Thiếc là kim loại có tính khử yếu hơn sắt, nếu xảy ra hiện tượng ăn mòn thì sắt bị ăn mòn trước.
Câu c
Thiếc được dùng nhiều hơn kẽm trong việc sản xuất đồ hộp thực phẩm bởi vì các hợp chất của thiếc an toàn hơn, không gây độc cho con người như hợp chất của kẽm. Tuy nhiên để bảo vệ ống nước, xô, chậu, mái tôn thì kẽm được ưu tiên hơn thiếc vì kẽm bảo vệ sắt chống ăn mòn điện hóa tốt hơn thiếc.
6. Giải bài 6 trang 223 SGK Hóa 12 nâng cao
a. Từ Fe hãy trình bày 3 phương pháp điều chế trực tiếp muối FeSO4. Viết các phương trình hóa học.
b. Từ hỗn hợp Ag và Cu, hãy tình bày 3 phương pháp hóa học tách riêng Ag và Cu. Viết các phương trình hóa học.
Phương pháp giải
a. Cần nắm rõ tính chất hóa học của sắt và FeSO4 để đưa ra phương pháp điều chế phù hợp.
b. Cần sử dụng 1 dung dihj để hòa tan 1 trong 2 kim loại. Lọc dung dịch thu được kim loại thứ 2. Sau đó, đưa kim loại đã hòa tan về kim loại ban đầu.
Hướng dẫn giải
Câu a
3 phương pháp điều chế trực tiếp muối FeSO4:
Fe + H2SO4 loãng → FeSO4 + H2
Fe + CuSO4 → FeSO4 + Cu
Fe + Fe2(SO4)3 → 3FeSO4
Câu b
3 phương pháp hóa học tách riêng Ag và Cu:
Cách 1:
- Hòa tan hỗn hợp bằng muối Fe(III); Cu tan còn Ag không tan, tách riêng:
Cu + 2Fe3+ → Cu2+ + 2Fe2+
- Cho sắt kim loại vào dung dịch thu được đồng:
Fe + Cu → Fe2+ + Cu
Cách 2:
- Hòa tan hỗn hợp bằng dung dịch HCl có sục khí oxi, Cu tan còn Ag không tan:
2Cu + 4HCl + O2 → 2CuCl2 + 2H2O
- Điện phân dung dịch thu được đồng:
CuCl2 \(\xrightarrow[\ ]{ \ dpdd \ }\) Cu + Cl2
Cách 3:
- Ngâm hỗn hợp bột kim loại trong dung dịch AgNO3 dư, thu được Ag:
CuCl2 + 2AgNO3 → Cu(NO3)2 + 2Ag
- Lọc lấy Ag không tan, phần dung dịch đem điện phân:
2Cu(NO3)2 + H2O \(\xrightarrow[\ ]{ \ dpdd \ }\) 2Cu + O2 + 4HNO3
7. Giải bài 7 trang 223 SGK Hóa 12 nâng cao
Có 3 lọ, mỗi lọ đựng một trong 3 hỗn hợp sau: Fe và FeO; Fe và Fe2O3; FeO và Fe2O3. Hãy dẫn ra cách nhận biết hỗn hợp chất đựng trong mỗi lọ bằng phương pháp hóa học và viết các phương trình hóa học.
Phương pháp giải
Cần tìm tính chất hóa học đặc trưng của mỗi chất để lựa chọn phương pháp nhận biết phù hợp.
Hướng dẫn giải
- Lấy chất trong từng lọ đem hòa tan bằng dung dịch HCl nhận ra hỗn hợp có chứa FeO và Fe2O3 và tan nhưng không sinh ra khí, 2 hỗn hợp kia tan và kèm theo hiện tượng thoát khí.
- Lấy phần dung dịch của hai hỗn hợp chưa nhận được, nhỏ từ từ dung dịch NaOH vào:
- Nhận ra hỗn hợp ban đầu là Fe và FeO do tạo dung dịch FeCl2 khi tác dụng với NaOH tạo kết tủa màu trắng xanh.
- Nhận ra hỗn hợp ban đầu là Fe và Fe2O3 do tạo dung dịch hỗn hợp FeCl2 và FeCl3 khi tác dụng với NaOH tạo kết tủa màu trắng xanh lẫn nâu đỏ.
Phương trình hóa học:
FeO + 2HCl → FeCl2 + H2O
Fe2O3 + 6HCl → FeCl3 + 3H2O
Fe + 2HCl → FeCl2 + H2\(^{\uparrow}\)
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
FeCl2 + 2NaOH → Fe(OH)2\(^{\downarrow}\) + 2NaCl
FeCl3 + 3NaOH → Fe(OH)3\(^{\downarrow}\) nâu đỏ + 3NaCl
8. Giải bài 8 trang 223 SGK Hóa 12 nâng cao
Khử 2,4 gam hỗn hợp CuO và một oxit sắt có tỉ lệ mol 1:1. Sau phản ứng thu được 1,76 gam chất rắn, đem hòa tan vào dung dịch HCl dư thấy thoát ra 0,448 lit khí (đktc). Xác định công thức của oxit sắt.
Phương pháp giải
- Bước 1: Sản phẩm khử CuO và oxit là Cu và Fe với tổng khối lượng hai kim loại là 1,76 gam; viết phương trình hóa học.
- Bước 2: Tính số mol sắt và oxi
- Bước 3: lập tỉ lệ x: y, suy ra công thức oxit sắt.
Hướng dẫn giải
Sản phẩm khử CuO và oxit là Cu và Fe với tổng khối lượng hai kim loại là 1,76 gam.
Fe + 2HCl → FeCl2 + H2
\(n_{Fe} = n_{H_{2}} = \frac{0,448}{22,4} = 0,02 \ mol\)
\(\\ \Rightarrow m_{Fe} = 0,02.56 = 1,12 \Rightarrow m_{Cu} = 1,76 - 1,12 = 0,64 \ gam \\ n_{Cu} = 0,01 \ mol = n_{CuO}\)
mCuO = 0,01 . 80 = 0,8 gam.
→ moxit sắt = 2,4 - 0,8 = 1,6 gam
→ nO(oxit sắt) = (1,6 - 1,12) / 16 = 0,03 mol
→ x : y = 0,02 : 0,03 = 2 : 3
⇒ Vậy oxit sắt là Fe2O3.
9. Giải bài 9 trang 223 SGK Hóa 12 nâng cao
Dung dịch A là FeSO4 có lẫn tạp chất Fe2(SO4)3. Để xác định nồng độ mol của mỗi chất trong dung dịch A, người ta tiến hành những thí nghiệm sau:
Thí nghiệm 1: Thêm dần dần dung dịch NaOH vào 200ml dung dịch A cho đến dư, đun nóng. Lọc lấy kết tủa, nung ở nhiệt độ cao đến khi khối lượng không đổi, được chất rắn duy nhất có khối lượng 1,2 gam.
Thí nghiệm 2: Thêm vài giọt dung dịch H2SO4 vào 20 ml dung dịch A, rồi nhỏ dần dần từng giọt dung dịch KMnO4 vào dung dịch trên lắc nhẹ. Khi đun nóng dung dịch có màu hồng thì ngừng thí nghiệm, người ta đã dùng hết 10ml dung dịch KMnO4 0,2M.
a. Giải thích quá trình thí nghiệm và viết các phương trình hóa học.
b. Tính nồng độ mol của mỗi chất có trong dung dịch A ban đầu.
c. Bằng phương pháp hóa học nào có thể loại bỏ được tạp chất trong dung dịch A ban đầu. Viết phương tình hóa học của phản ứng đã dùng.
Phương pháp giải
a. Để giải thích quá trình thí nghiệm ta dựa vào dữ kiện đề bài và lý thuyết về hợp chất của sắt.
b. Từ phương trình hóa học, đặt số mol FeSO4 và Fe2(SO4)3 lần lượt là x và y
Lập hệ 2 phương trình, giải x và y, suy ra nồng độ mol của mỗi chất.
c. Để loại bỏ tạp chất trong dung dịch A ban đầu ta, ngâm một đinh sắt vào A sẽ loại được Fe2(SO4)3
Hướng dẫn giải
Câu a
- Thí nghiệm 1:
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4 (1)
Fe2(SO4)3 + 6NaOH → 2Fe(OH)3 + 3NaCl (2)
4Fe(OH)2 + O2 \(\overset{t^0}{\rightarrow}\) 2Fe2O3 + 4H2O (3)
2Fe(OH)3 \(\overset{t^0}{\rightarrow}\) Fe2O3 + 3H2O (4)
- Thí nghiệm 2:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O (5)
Câu b
Đặt số mol FeSO4 và Fe2(SO4)3 lần lượt là x và y
- Thí nghiệm 1:
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4 (1)
x x
Fe2(SO4)3 + 6NaOH → 2Fe(OH)3 + 3NaCl (2)
y 2y
4Fe(OH)2 + O2 \(\overset{t^0}{\rightarrow}\) 2Fe2O3 + 4H2O (3)
x 0,5x
2Fe(OH)3 \(\overset{t^0}{\rightarrow}\) Fe2O3 + 3H2O (4)
2y y
- Thí nghiệm 2:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O (5)
x 0,2x
Từ (1), (2), (3), (4), và (5) ta có hệ phương trình:
Nồng độ mol/l của các chất có trong dung dịch A:
\(\\ C_{M \ FeSO_{4}} = \frac{0,01}{0,02} = 0,5 M \\ C_{M \ Fe_{2}(SO_{4})_{3}} = \frac{0,0025}{0,02} = 0,125M\)
Câu c
Để loại bỏ tạp chất trong dung dịch A ban đầu ta, ngâm một đinh sắt vào A sẽ loại được Fe2(SO4)3
Fe + Fe2(SO4)3 → 3FeSO4
Tham khảo thêm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 38: Crom
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 39: Một số hợp chất của crom
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 40: Sắt
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 41: Một số hợp chất của sắt
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 42: Hợp kim của sắt
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 43: Đồng và một số hợp chất của đồng
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 44: Sơ lược về một số kim loại khác
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 46: Luyện tập: Tính chất của đồng và hợp chất của đồng. Sơ lược về các kim loại Ag, Au, Ni, Zn, Sn, Pb