Giải bài tập SGK Hóa 12 Nâng cao Bài 34: Một số hợp chất quan trong của nhôm
Hướng dẫn Giải bài tập Hóa học 12 nâng cao Bài 34 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về một số hợp chất quan trong của nhôm. Mời các em cùng theo dõi.
Mục lục nội dung

1. Giải bài 1 trang 180 SGK Hóa 12 nâng cao
Hợp chất nào của nhôm tác dụng với dung dịch NaOH (theo tỉ lệ mol 1:1) có sản phẩm là Na[Al(OH)4]?
A. Al2(SO4)3
B. AlCl3
C. Al(NO3)3
D. Al(OH)3
Phương pháp giải
Để xác định hợp chất nào của nhôm tác dụng với dung dịch NaOH (theo tỉ lệ mol 1:1) có sản phẩm là Na[Al(OH)4] ta cần viết phương trình hóa học của các hợp chất trên với NaOH, cân bằng phương trình và xác định hệ số cân bằng đề chọn đáp án phù hợp.
Hướng dẫn giải
Hợp chất Al(OH)3 của nhôm tác dụng với dung dịch NaOH (theo tỉ lệ mol 1:1) có sản phẩm là Na[Al(OH)4]
Phương trình hóa học: Al(OH)3 + NaOH → Na[Al(OH)4]
⇒ Đáp án D.
2. Giải bài 2 trang 180 SGK Hóa 12 nâng cao
Dãy nào dưới đây gồm các chất vừa tác dụng được với dung dịch axit và dung dịch kiềm?
A. AlCl3 và Al2(SO4)3
B. Al(NO3)3 và Al(OH)3
C. Al2(SO4)3 và Al2O3
D. Al(OH)3 và Al2O3
Phương pháp giải
Để chọn đáp án thích hợp ta cần ghi nhớ những hợp chất có tính chất lưỡng tính vừa tác dụng được với dung dịch axit và dung dịch kiềm.
Hướng dẫn giải
Dãy gồm các chất vừa tác dụng được với dung dịch axit và dung dịch kiềm là: Al(OH)3 và Al2O3.
⇒ Đáp án D.
3. Giải bài 3 trang 180 SGK Hóa 12 nâng cao
Có 3 chất rắn là: Mg, Al2O3, Al. Hãy nhận biết mỗi chất đã cho bằng phương pháp hóa học. Viết các phương trình hóa học.
Phương pháp giải
Để nhận biết các chất trên ta dựa vào tính chất khác biệt và đặc trưng của mỗi chất để lựa chọn thuốc thử và phương pháp phù hợp.
Hướng dẫn giải
Cách nhận biết mỗi chất đã cho bằng phương pháp hóa học:
- Dùng dung dịch NaOH hòa tan 3 mẫu chất rắn
- Chất rắn không tan là Mg.
- Chất rắn tan ra là Al2O3:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
- Chất rắn tan ra và kèm theo hiện tượng thoát khí là Al:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2\(^{\uparrow}\)
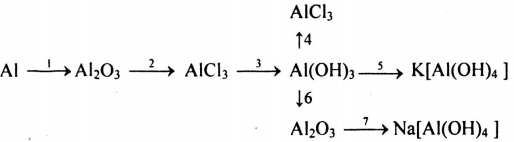
4. Giải bài 4 trang 181 SGK Hóa 12 nâng cao
Viết các phương trình hóa học biểu diễn những chuyển đổi hóa học sau, ghi rõ các điều kiện của phản ứng và cho biết phản ứng nào thuộc loại phản ứng oxi hóa khử:
Phương pháp giải
Để viết phương trình hóa học cần dựa vào chất sản phẩm và chất tham gia phản ứng để suy ra những chất còn lại và viết phương trình hóa học.
Hướng dẫn giải
Các phương trình hóa học của dãy chuyển hóa trên:
(1) 4Al + 3O2 \(\xrightarrow{{{t^o}}}\) Al2O3
(2) Al2O3 + 6HCl → 2AlCl3 + 3H2O
(3) AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
(4) Al(OH)3 + 3HCl → AlCl3 + 3H2O
(5) Al(OH)3 + KOH → K[Al(OH)4]
(6) 2Al(OH)3 \(\overset{t^0}{\rightarrow}\) Al2O3 + 3H2O
(7) Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Trong các phản ứng đã cho (1) là phản ứng oxi hóa khử.
5. Giải bài 5 trang 181 SGK Hóa 12 nâng cao
Có các dung dịch AlCl3, HCl, NaOH, H2O và những dụng cụ cần thiết. Hãy điều chế và chứng minh tính lưỡng tính của Al2O3 và Al(OH)3. Viết các phương trình hóa học.
Phương pháp giải
- Cần dựa vào những chất sẵn có và cách điều chế Al2O3 và Al(OH)3 để viết phương trình hóa học phù hợp.
- Để chứng minh tính lưỡng tính ta cần viết các phương trình hóa học tác dụng với axit và bazơ.
Hướng dẫn giải
- Điều chế Al2O3 và Al(OH)3:
- Lấy một lượng dung dịch AlCl3 nhỏ từng giọt dung dịch NaOH vào cho tới khi lượng kết tủa không tăng thêm nữa thì dừng.
AlCl3 + 3NaOH → Al(OH)3\(^{\downarrow}\) + 3NaCl
- Đem nung đến kết tủa đến khối lượng không đổi để tạo Al2O3:
2Al(OH)3 \(\overset{t^0}{\rightarrow}\) Al2O3 + 3H2O
- Chứng minh tính lưỡng tính của Al2O3 và Al(OH)3:
Al2O3 và Al(OH)3 vừa cho proton H+ vừa nhận proton H+
Al(OH)3\(^{\downarrow}\) + 3HCl → AlCl3 + H2O
Al(OH)3 + KOH → K[Al(OH)4]
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
6. Giải bài 6 trang 181 SGK Hóa 12 nâng cao
Cho 31,2gam hỗn hợp bột Al và Al2O3 tác dụng với dung dịch NaOH dư, phản ứng xong thu được 13,44 lít H2 (đktc). Hãy cho biết:
a. Các phương trình hóa học của các phản ứng đã xảy ra?
b. Khối lượng mỗi chất có trong hỗn hợp ban đầu?
c. Thể tích dung dịch NaOH 4M đã dùng (biết rằng trong thí nghiệm này người ta đã dùng dư 10 cm3 so với thể tích cần dùng).
Phương pháp giải
- Bước 1: Viết phương trình hóa học
- Bước 2: Từ số mol H2 suy ra mol Al và A2O3
- Bước 3: Tính khối lượng mỗi chất có trong hỗn hợp ban đầu.
- Bước 4: Tính mol NaOH theo mol Al và A2O3, suy ra thể tích dung dịch NaOH cần dùng.
Hướng dẫn giải
Câu a
Phương trình hóa học:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (1)
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2\(^{ \uparrow}\) (2)
Câu b
\(n_{H_{2}} = \frac{13,44}{22,4} = 0,6 \ mol\)
Theo phương trình (2):
\(n_{Al} = \frac{2}{3} n_{H_{2}} = 0,4 \ mol \Rightarrow m_{Al} = 0,4.27 = 10,8 \ gam\)
\(m_{Al_{2}O_{3}} = 31,2 - 10,8 = 20,4 \ gam \Rightarrow n_{Al_{2}O_{3}} = 0,2 \ mol\)
Câu c
\(\\ Theo \ (1): \ n_{NaOH} = 2n_{Al_{2}O_{3}} = 0,4 \ mol \\ Theo \ (2): \ n_{NaOH} = n_{Al} = 0,4 \ mol\)
⇒ nNaOH = 0,4 + 0,4 = 0,8 mol.
\(V_{NaOH} = \frac{0,8}{4} = 0,2 \ lit = 200 \ cm^3\)
Vì trong thí nghiệm này người ta đã dùng dư 10 cm3 so với thể tích cần dùng nên:
Thể tích dung dịch NaOH đã dùng là:
V'NaOH = 200 + 10 = 210 cm3.
7. Giải bài 7 trang 181 SGK Hóa 12 nâng cao
Cho 150 cm3 dung dịch NaOH 7M tác dụng với 100 cm3 dung dịch Al2(SO4)3 1M. Hãy xác định nồng độ mol của các chất có trong dung dịch sau phản ứng.
Phương pháp giải
- Bước 1: Từ mol NaOH và Al2(SO4)3 xác định chất còn dư sau phản ứng.
- Bước 2: Tính thể tích dung dịch, suy ra nồng độ mol. của các chất có trong dung dịch sau phản ứng
Hướng dẫn giải
Ta có:
nNaOH = 0,15 . 7 = 1,05 mol
\({n_{A{l_2}{{(S{O_4})}_3}}}\) = 0,1 . 1 = 0,1 mol
Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4
0,1 0,6 0,2 0,3
Do NaOH còn dư 1,05 - 0,6 = 0,45 mol nên Al(OH)3 sinh ra bị hòa tan:
Al(OH)3 + NaOH → Na[Al(OH)4]
0,2 0,2 0,2
Sau thí nghiệm các chất có trong dung dịch là:
Na2SO4 0,3 mol; Na[Al(OH)4] 0,2 mol; NaOH dư 1,05 - 0,6 - 0,2 = 0,25 mol
Thể tích dung dịch: Vdd = 150 + 100 = 250 ml = 0,25 lít
Nồng độ các chất trong dung dịch:
\(\\ C_{M \ Na_{2}SO_{4}} = \frac{0,3}{0,25} = 1,2 M \\ C_{M \ Na[Al(OH)]_{4}} = \frac{0,2}{0,25} = 0,8 M \\ C_{M \ NaOH} = \frac{0,25}{0,25} = 1M\)
Tham khảo thêm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 28: Kim loại kiềm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 29: Một số hợp chất quan trọng của kim loại kiềm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 30: Kim loại kiềm thổ
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 31: Một số hợp chất quan trọng của kim loại kiềm thổ
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 32: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 33: Nhôm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 35: Luyện tập: Tính chất của nhôm và hợp chất của nhôm