Giải bài tập SGK Hóa 12 Nâng cao Bài 21: Luyện tập: Tính chất của kim loại
Hướng dẫn Giải bài tập Hóa học 12 nâng cao Bài 21 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về tính chất của kim loại. Mời các em cùng theo dõi.
Mục lục nội dung
1. Giải bài 1 trang 125 SGK Hóa 12 nâng cao
2. Giải bài 2 trang 125 SGK Hóa 12 nâng cao
3. Giải bài 3 trang 125 SGK Hóa 12 nâng cao
4. Giải bài 4 trang 125 SGK Hóa 12 nâng cao
5. Giải bài 5 trang 126 SGK Hóa 12 nâng cao
6. Giải bài 6 trang 126 SGK Hóa 12 nâng cao
7. Giải bài 7 trang 126 SGK Hóa 12 nâng cao
8. Giải bài 8 trang 126 SGK Hóa 12 nâng cao

1. Giải bài 1 trang 125 SGK Hóa 12 nâng cao
a) Phản ứng hóa học xảy ra trong pin điện hóa :
2Cr + 3Cu2+ → 2Cr3+ + 3Cu
Eo của pin điện hóa là :
A. 0,40V
B. 1,08V
C. 1,25V
D. 2,5V
Biết Eo Cu2+/Cu = +0,34; Eo Cr3+/Cr = -0,74 V
b) Phản ứng hóa học xảy ra trong pin điện hóa :
2Au3+ + 3Ni → 2Au + 3Ni2+
Eo của pin điện hóa là :
A. 3,75 V
B. 2,25 V
C. 1,76 V
D. 1,25 V
Phương pháp giải
a) Eo pin = Eo Cu2+/Cu - Eo Cr3+/Cr
b) Eo pin = Eo Au3+/Au - Eo Ni2+/Ni
Hướng dẫn giải
Câu a
Eo pin = Eo Cu2+/Cu - Eo Cr3+/Cr = 0,34 - (-0,74)= 1,08 V
→ Đáp án B.
Câu b
Eo pin = Eo Au3+/Au - Eo Ni2+/Ni = 1,5 – (-0,26) = 1,76 V
→ Đáp án C.
2. Giải bài 2 trang 125 SGK Hóa 12 nâng cao
a. Chất nào sau đây có thể oxi hóa Zn thành Zn2+?
A. Fe
B. Ag+
C. Al3+
D. Ca2+
b. Kim loại Zn có thể khử được các ion nào sau đây?
A. Na+
B. H+
C. Ca2+
D. Mg2+
Phương pháp giải
a) Để lựa chọn chất có thể oxi hóa Zn thành Zn2+ ta chọn chất xảy ra quá trình khử và đứng sau Zn trong dãy điện h
b) Kim loại Zn có thể khử được các ion đứng sau Zn trong dãy điện hóa.
Hướng dẫn giải
Câu a
Zn + 2Ag+ → Zn2+ + 2Ag
→ Đáp án B.
Câu b
Zn + 2H+ → Zn2+ + H2
→ Đáp án B.
3. Giải bài 3 trang 125 SGK Hóa 12 nâng cao
Trong quá trình pin điện hóa Zn – Ag hoạt động, ta nhận thấy :
A. Khối lượng của điện cực Zn tăng.
B. Khối lượng của điện cực Ag giảm.
C. Nồng độ của ion Zn2+ trong dung dịch tăng.
D. Nồng độ của ion Ag+ trong dung dịch tăng.
Phương pháp giải
Để chọn đáp án đúng cần xét xem sau phản ứng chất nào tăng, chất nào giảm.
Hướng dẫn giải
Trong quá trình pin điện hóa Zn – Ag hoạt động, ta nhận thấy nồng độ của ion Zn2+ trong dung dịch tăng.
⇒ Đán án C.
4. Giải bài 4 trang 125 SGK Hóa 12 nâng cao
Dưới đây là hình vẽ của 4 sơ đồ pin điện hóa chuẩn. Hãy cho biết sơ đồ nào được vẽ và chú thích đúng, sai. Đề nghị sửa lại những chỗ sai.
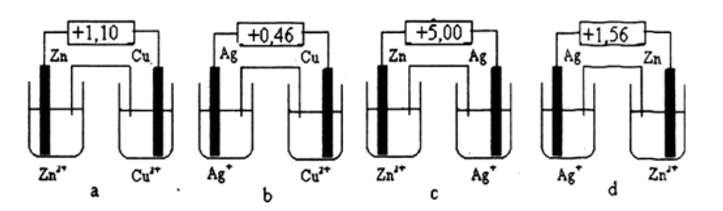
Cho biết Eo Ag+/Ag = +0,80 V
Eo Cu2+/Cu = +0,34 V
Eo Zn2+/Zn = -0,76 V
Phương pháp giải
Để xét xem sơ đồ điện hóa nào đúng, sai ta dựa vào các cực của pin điện hóa và suất điện động của pin điện hóa.
Hướng dẫn giải
- Sơ đồ a vẽ đúng, suất điện động chuẩn của pin ghi đúng.
- Sơ đồ b vẽ sai, suất điện động chuẩn của pin ghi đúng.
- Sơ đồ c vẽ đúng, suất điện động chuẩn của pin ghi sai.
- Sơ đồ d vẽ sai, suất điện động chuẩn của pin ghi đúng.
Sửa lại như sau :
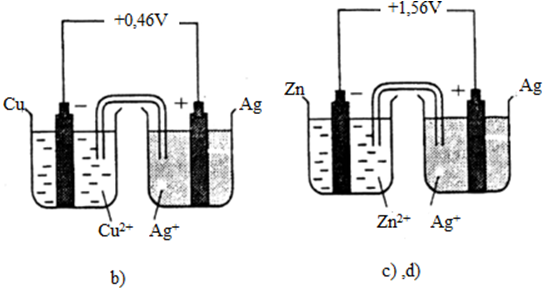
5. Giải bài 5 trang 126 SGK Hóa 12 nâng cao
Khi nhúng một lá Zn vào dung dịch muối Co2+, nhận thấy có một lớp kim loại Co phủ ngoài lá kẽm. Khi nhúng lá Pb và dung dịch muối trên, không nhận thấy hiện tượng nào xảy ra.
a. Kim loại nào có tính khử mạnh nhất trong số 3 kim loại trên.
b. Cation nào có tính oxi hóa mạnh nhất trong số 3 cation kim loại trên.
c. Sắp xếp cặp oxi hóa – khử của những kim loại trên theo chiều tính oxi hóa của cation tăng dần.
d. Viết phương trình hóa học của phản ứng xảy ra giữa các cặp oxi hóa – khử.
Phương pháp giải
Để trả lời các câu hỏi trên cần dựa vào chất tham gia và sản phẩm của đề bài để xác định kim loại có tính khử mạnh nhất, cation có tính oxi hóa mạnh nhất, sắp xếp theo chiều tăng dần tính oxi hóa của cation và viết hương trình hóa học của phản ứng xảy ra giữa các cặp oxi hóa – khử.
Hướng dẫn giải
Câu a
Zn đẩy được Co; Pb không đẩy được Co
⇒ Zn có tính khử mạnh nhất.
Câu b
Cation có tính oxi hoá mạnh nhất là Pb2+.
Câu c
Xếp theo chiều tăng dần tính oxi hóa của cation : Zn2+/Zn; Co2+/Co; Pb2+/Pb
Câu d
Các phản ứng xảy ra giữa các cặp oxi hóa khử:
Zn + Co2+ → Zn2+ + Co
Zn + Pb2+ → Zn2+ + Pb
Co + Pb2+ → Co2+ + Pb
6. Giải bài 6 trang 126 SGK Hóa 12 nâng cao
Hãy giải thích hiện tượng thí nghiệm: Ngâm một lá Zn nhỏ, tinh khiết trong dung dịch HCl thấy bọt khí H2 thoát ra ít và chậm. Nếu nhỏ thêm vài giọt dung dịch CuSO4 thấy bọt khí H2 thoát ra rất nhiều và nhanh.
Phương pháp giải
Để giải thích hiện tượng của thí nghiệm trên, ta dựa vào chất tham gia phản ứng và sản phẩm để viết phương trình hóa học.
Hướng dẫn giải
- Ngâm một lá Zn nhỏ, tinh khiết trong dung dịch HCl thì xảy ra phản ứng:
Zn + 2HCl → ZnCl2 + H2
- Bọt khí hiđro thoát ra ít và chậm do H2 sinh ra trên bề mặt lá kẽm cản trở phản ứng. Khi thêm CuSO4 thấy bọt khí H2 thoát ra rất nhiều và nhanh hơn, Zn bị hoà tan nhanh do có sự ăn mòn điện hoá.
Zn + CuSO4 → ZnSO4 + Cu
- Cu được giải phóng bám trên viên kẽm hình thành cặp pin điện hóa Zn – Cu trong đó:
- Zn là cực âm và bị ăn mòn: Zn → Zn2+ + 2e
- Electron đến cực dương là Cu, tại đâ:y 2H+ + 2e → H2
- Bọt khí hiđro thoát ra ở cực dương nhiều và liên tục.
7. Giải bài 7 trang 126 SGK Hóa 12 nâng cao
Cho cặp oxi hóa – khử sau : Ag+/Ag; Fe2+/Fe; Zn2+/Zn
a) Hãy viết các phản ứng biến đổi qua lại giữa cation kim loại và nguyên tử kim loại trong mỗi cặp
b) Hãy cho biết trong các cặp oxi hóa – khử đã cho, chất nào có tính
1. oxi hóa mạnh nhất?
2. oxi hóa yếu nhất ?
3. khử mạnh nhất?
4. khử yếu nhất?
Phương pháp giải
a) Dựa vào cặp oxi hóa – khử xác định chất khử và chất oxi hóa để viết phương trình.
b) Dựa vào dãy điện hóa để xác định chất oxi hóa mạnh nhất, yếu nhất, khử mạnh nhất, yếu nhất.
Hướng dẫn giải
Câu a
Các phản ứng biến đổi qua lại giữa cation kim loại và nguyên tử kim loại trong mỗi cặp:
Ag+ + e → Ag
Fe2+ + 2e → Fe
Zn2+ + 2e → Zn
Câu b
Trong các cặp oxi hóa – khử đã cho:
- Chất oxi hóa mạnh nhất : Ag+
- Chất oxi háo yếu nhất : Zn2+
- Chất khử mạnh nhất : Zn
- Chất khử yếu nhất : Ag
8. Giải bài 8 trang 126 SGK Hóa 12 nâng cao
Hãy tính thế điện cực chuẩn của cặp oxi hóa – khử Eo Zn2+/Zn. Biết rằng Epđh Zn-Cu = 1,10 V và Eo Cu2+/Cu = +0,34 V
Phương pháp giải
Để tính thế điện cực chuẩn của cặp oxi hóa – khử Eo Zn2+/Zn ta dựa vào Epđh = Eo Cu2+/Cu - Eo Zn2+/Zn
Hướng dẫn giải
Thế điện cực chuẩn của cặp oxi hóa – khử Eo Zn2+/Zn là:
Epđh = Eo Cu2+/Cu - Eo Zn2+/Zn = +1,1 V ⇒ Eo Zn2+/Zn = +0,34 – 1,1 = -0,76 V.
9. Giải bài 9 trang 126 SGK Hóa 12 nâng cao
Có những pin điện hóa được tạo thành từ những cặp oxi hóa – khử sau :
a) Pb2+/Pb và Fe2+/Fe
b) Ag+/Ag và Fe2+/Fe
c) Ag+/Ag và Pb2+/Pb
Hãy tính suất điện động chuẩn của mỗi pin điện hóa
Biết rằng : Eo Ag+/Ag = +0,80 V
Eo Pb2+/Pb = -0,13 V
Eo Fe2+/Fe = -0,44 V
Phương pháp giải
Để tính suất điện động chuẩn của mỗi pin điện hóa cần xác định thế điện cực chuẩn của cực dương và thế điện cực chuẩn của cực âm.
Hướng dẫn giải
Câu a
Suất điện động chuẩn của mỗi pin điện hóa:
Eo Fe-Pb = Eo Pb2+/Pb - Eo Fe2+/Fe = -0,13 – (-0,44) = +0,31 V.
Câu b
Suất điện động chuẩn của mỗi pin điện hóa:
Eo Fe-Ag = Eo Ag+/Ag - Eo Fe2+/Fe = +0,8 - (-0,44) = + 1,24 V.
Câu c
Suất điện động chuẩn của mỗi pin điện hóa:
Eo Pb-Ag = Eo Ag+/Ag - Eo Pb2+/Pb = +0,8 - (-0,13) = +0,93 V.
10. Giải bài 10 trang 126 SGK Hóa 12 nâng cao
Có những pin điện hóa được ghép bởi những cặp oxi hóa – khử chuẩn sau :
a) Pb2+/Pb và Zn2+/Zn
b) Mg2+/Mg và Pb2+/Pb
Hãy tính thế điện cực chuẩn?
Phương pháp giải
Để tính thế điện cực chuẩn của mỗi pin điện hóa cần xác định thế điện cực chuẩn của cực dương và thế điện cực chuẩn của cực âm.
Hướng dẫn giải
Câu a
Phản ứng trong pin điện hóa : Zn + Pb2+ → Zn2+ + Pb
Zn → Zn2+ +2e
Zn : cực âm, anot
Pb2+ + 2e → Pb
Pb : cực dương, catot
Thế điện cực chuẩn: Eo Zn-Pb = -0,13 - (-0,76) = +0,63 V.
Câu b
Phản ứng trong pin điện hóa : Mg + Pb2+ → Mg2+ + Pb
Mg → Mg2+ +2e
Mg: cực âm, anot
Pb2+ + 2e → Pb
Pb: cực dương, catot
Thế điện cực chuẩn: Eo Mg-Pb = -0,13 - (-2,37) = +2,24 V.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 19: Kim loại và hợp kim
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 20: Dãy điện hóa của kim loại
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 22: Sự điện phân
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 23: Sự ăn mòn kim loại
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 24: Điều chế kim loại
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 25: Luyện tập: Sự điện phân, sự ăn mòn kim loại, điều chế kim loại.



