Hoá học 11 Bài 15: Cacbon
Nội dung bài học Cacbon tìm hiểu vị trí của cacbon trong bảng tuần hoàn các nguyên tố hoá học, cấu hình electron nguyên tử, các dạng thù hình của cacbon, tính chất vật lí (cấu trúc tinh thể, độ cứng, độ dẫn điện), ứng dụng. Cacbon có tính phi kim yếu (oxi hóa hiđro và kim loại canxi), tính khử ( khử oxi, oxit kim loại). Trong một số hợp chất, cacbon thường có số oxi hóa +2 hoặc +4.
Mục lục nội dung

1. Tóm tắt lý thuyết
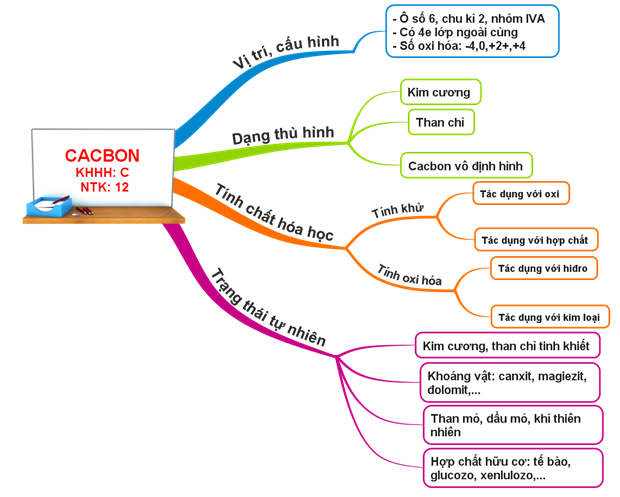
1.1. Vị trí và cấu hình electron nguyên tử
- Vị trí: Ô thứ 6, nhóm IVA, chu kì 2
- Cấu hình e: 1s2 2s2 2p2→ Có 4 e lớp ngoài cùng, tạo 4 liên kết cộng hoá trị
- Các số oxi hoá: -4, 0, +2 và +4
1.2. Tính chất vật lí
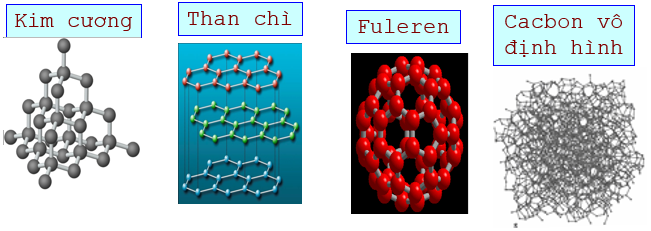
- Kim cương:
+ Cấu trúc: Tứ diện đều
+ Tính chất vật lý: Trong suốt, không màu, không dẫn điện, dẫn nhiệt kém
+ Ứng dụng: Đồ trang sức, mũi khoan, dao cắt thuỷ tinh...
- Than chì:
+ Cấu trúc: Cấu trúc lớp. Các lớp liên kết yếu với nhau
+ Tính chất vật lý: màu xám đen, dẫn điện tốt, mềm, các lớp dễ tách nhau
+ Ứng dụng: Làm điên cực, làm nồi nấu chảy các hợp kim chịu nhiệt, chế tạo chất bôi trơn, làm bút chì đen
- Cacbon vô định hình:
+ Cấu trúc: Xốp
+ Tính chất vật lý: Khả năng hấp phụ mạnh
+ Ứng dụng: Than cốc dùng làm chất khử trong luyện kim; than hoạt tính dùng trong mặt nạ phòng độc; Than muội dùng làm chất độn cao su, sản xuất mực in, xi đánh giày...
1.3. Tính chất hóa học
Cacbon vừa thể hiện tính khử vừa thể hiện tính oxi hoá
a. Tính khử
Tác dụng với oxi
Cacbon cháy trong không khí, toả nhiều nhiệt
C + O2 → CO2
Tác dụng với hợp chất
Ở nhiệt độ cao, cacbon khử được nhiều oxit, nhiều chất oxi hoá khác nhau
C + CO2 → 2CO
C + 4HNO3 (đặc) → CO2 + 4NO2 + 2H2O
3C + 2KClO3 → 2KCl + 3CO2
C + ZnO → Zn + CO
C + CuO → Cu + CO
Video 1: Cacbon khử Đồng (II) oxit tạo thành CO2 , khí CO2 làm đục nước vôi trong
b. Tính oxi hoá
Ở nhiệt độ cao
Tác dụng với hiđro
C + H2 → CH4
Tác dụng với kim loại
4Al + 3C → Al4C3 (Nhôm cacbua)
Ca + 2C → CaC2 (Canxi cacbua)
1.4. Trạng thái tự nhiên

1.5. Tổng kết
2. Bài tập minh họa
Bài toán khử oxit kim loại bằng C và CO
Phương pháp giải
M2On + nCO tº→ 2M + nCO2↑
- Sử dụng định luật bảo toàn nguyên tố C để giải toán kết hợp với định luật bảo toàn khối lượng.
moxit KL + mCO = mKL + mCO2
→ nO(Oxit) = nCO = nCO2 và moxitKL = mKL + mO
Chú ý: Đốt cháy Cacbon bởi oxi: Có 2 trường hợp
+ Nếu thừa oxi: C + O2 → Hỗn hợp khí sau phản ứng gồm CO2 và O2 (dư).
+ Nếu thiếu oxi: C + O2 → Hỗn hợp khí sau phản ứng gồm CO2 và CO dư.
Bài 1: Khử 16g hỗn hợp các oxit kim loại: FeO, Fe2O3, Fe3O4, CuO, PbO bằng khí CO ở nhiệt độ cao, khối lượng chất rắn thu được là 11,2 g. Tính thể tích khi CO đã tham gia phản ứng (đktc)
Hướng dẫn giải
Áp dụng ĐLBT khối lượng
nCO2 = nCO = x mol
moxit + mCO = mCR + mCO2
16 + 28x = 11,2 + 44x ⇒ x=0,3
⇒ VCO = 6,72 lit
Bài 2: Dẫn một luồng khí CO dư qua ống sứ đựng Fe3O4 và CuO nung nóng đến khi phản ứng hoàn toàn thu được 2,32 gam hỗn hợp kim loại. Khí thoát ra khỏi bình được dẫn qua dung dịch nước vôi trong dư thu được 5 gam kết tủa. Tính tổng khối lượng 2 oxit trong hỗn hợp đầu.
Hướng dẫn giải
Phương trình phản ứng:
4CO + Fe3O4 → 4CO2↑ + 3Fe
CO + CuO → CO2↑ + Cu
CO2 + Ca(OH)2 → CaCO3↓ + H2O
nCO2 = nCaCO3 = 5/100 = 0,05 mol
Áp dụng định luật bảo toàn nguên tố C ta có: nCO = nCO2 = 0,05 mol
Áp dụng định luật bảo toàn khối lượng ta có: moxit kl + mCO = mkl + mCO2
⇒ moxit kl = 2,32 + 0,05.44 – 0,05,28 = 3,12 gam
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Đốt cháy hết m gam than (C) trong V lít oxi thu được 2,24 lít hỗn hợp X gồm 2 khí. Tỉ khối của X so với oxi bằng 1,25. Các thể tích đo được (đktc). Giá trị của m là?
Câu 2: Cho m gam than (C) tác dụng với dung dịch HNO3 đặc nóng dư thu được 11,2 lít hỗn hợp X gồm 2 khí (đktc) (NO2 là sản phẩm khử duy nhất). Giá trị của m là?
Câu 3: Cho các chất: O2 (1), CO2 (2), H2 (3), Fe2O3 (4), SiO2 (5), HCl (6), CaO (7), H2SO4 đặc (8), HNO3 (9), H2O (10), KMnO4 (11). Cacbon phản ứng trực tiếp được với bao nhiêu chất?
Câu 4: Cho cacbon (C) lần lượt tác dụng với Al, H2O, CuO, HNO3 đặc, KClO3, CO2, H2SO4 đặc ở điều kiện thích hợp. Số phản ứng mà trong đó C đóng vai trò là chất khử?
3.2. Bài tập trắc nghiệm
Câu 1: Vật liệu dưới đây được dùng để chế tạo ruột bút chì?
A. Chì.
B. Than đá.
C. Than chì.
D. Than vô định hình.
Câu 2: Câu nào sau đây đúng? Trong các phản ứng hóa học
A. cacbon chỉ thể hiện tính khử.
B. cacbon chỉ thể hiện tính oxi hóa.
C. cacbon không thể hiện tính khử hay tính oxi hóa.
D. cacbon thể hiện cả tính oxi hóa và tính khử
Câu 3: Kim cương được sử dụng làm mũi khoan, dao cắt thủy tinh và bột mài vì kim cương là chất có độ cứng rất lớn. Tính chất trên một phần là do tinh thể kim cương thuộc loại tinh thể
A. nguyên tử điển hình.
B. kim loại điển hình.
C. ion điển hình.
D. phân tử điển hình.
Câu 4: Tủ lạnh dùng lâu ngày thường có mùi hôi. Để khử mùi người ta thường cho vào tủ lạnh một mẩu than gỗ. Than gỗ lại có khả năng khử mùi hôi là vì
A. than gỗ có tính khử mạnh.
B. than gỗ xúc tác cho quá trình chuyển hóa các chất khí có mùi hôi thành chất không mùi.
C. than gỗ có khả năng phản ứng với các khí có mùi tạo thành chất không mùi.
D. than gỗ có khả năng hấp phụ các khí có mùi hôi.
Câu 5: Tính khử của cacbon thể hiện trong phản ứng nào sau đây?
A. 2C + Ca → CaC2.
B. C + 2H2 → CH4.
C. C + CO2 → 2CO.
D. 3C + 4Al → Al4C3.
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Cacbon Hóa học 11 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Vị trí của cacbon trong bảng tuần hoàn các nguyên tố hoá học, cấu hình electron nguyên tử.
- Các dạng thù hình của cacbon, tính chất vật lí (cấu trúc tinh thể, độ cứng, độ dẫn điện), ứng dụng.
Tham khảo thêm
- doc Hoá học 11 Bài 16: Hợp chất của cacbon
- doc Hoá học 11 Bài 17: Silic và hợp chất của silic
- doc Hoá học 11 Bài 18: Công nghiệp silicat
- doc Hoá học 11 Bài 19: Luyện tập Tính chất hóa học của cacbon, silic và các hợp chất của chúng



