Hoá học 11 Bài 8: Amoniac và muối amoni
Nội dung bài học Amoniac và muối amoni tìm hiểu về cấu tạo phân tử, tính chất vật lí (tính tan, tỉ khối, màu, mùi), ứng dụng chính, amoniac trong phòng thí nghiệm và trong công nghiệp . Tính chất hoá học của amoniac: Tính bazơ yếu (tác dụng với nước, dung dịch muối, axit) và tính khử (tác dụng với oxi, clo). Cách điều chế NH3. Tính chất vật lí (trạng thái, màu sắc, tính tan). Tính chất hoá học (phản ứng với dung dịch kiềm, phản ứng nhiệt phân) và ứng dụng của muối amoni.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Amoniac
a. Cấu tạo phân tử
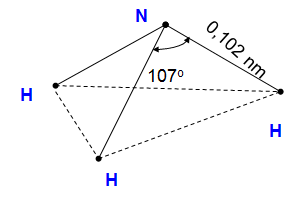
- Nguyên tử N liên kết với 3 nguyên tử H bằng 3 liên kết cộng hóa trị có cực.
- Nguyên tử N còn có 1 cặp e hoá trị.
- Nguyên tử N có số oxi hóa thấp nhất -3
- Phân tử có cấu tạo không đối xứng nên phân tử NH3 phân cực.
b. Tính chất vật lý
- Là chất khí không màu, mùi khai, xốc, nhẹ hơn không khí
- Tan nhiều trong nước, tạo thành dd có tính kiềm
Video 1: Sự hòa tan của Amoniac trong nước
- Khí NH3 tan nhiều trong nước làm giảm P trong bình và nước bị hút vào bình. Phenolphtalein chuyển thành màu hồng ⇒ NH3 có tính bazơ.
- Dung dịch NH3 đậm đặc trong phòng thí nghiệm có nồng độ 25% (N = 0,91g/cm3).
c. Tính chất hóa học
Tính bazơ yếu
Tác dụng với nước
- Khi hoà tan khí NH3 vào nước, 1 phần các phân tử NH3 phản ứng tạo thành dd bazơ ⇒ dd NH3 là bazơ yếu:
NH3 + H2O ⇔ NH4+ + OH-
- Làm quỳ tím chuyển sang màu xanh
Tác dụng với dung dịch bazơ
- Dung dịch NH3 có khả năng làm kết tủa nhiều hidroxít kim loại
AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
Al3+ + 3NH3 + 3H2O → Al(OH)3 + 3NH4+
Tác dụng với axít
2NH3 + H2SO4 → (NH4)2SO4
NH3 (k) + HCl (k) → NH4Cl
(không màu) (ko màu) (khói trắng)
Video 2: Amoniac tác dụng với axit clohidric
Tính khử
Trong phân tử NH3, N có số oxi hóa là -3. Nitơ có các số oxi hóa là -3,0,+1,+2,+3,+4,+5. Như vậy trong các phản ứng hóa học khi có sự thay đổi số oxi hóa, số oxi hóa của N trong NH3 chỉ có thể tăng lên
→ thể hiện tính khử.
Tác dụng với oxi
Video 3: Thí nghiệm giữa NH3 và Oxi
NH3 được tạo ra từ phản ứng của NH4Cl và CaO
Khí O2 được tạo ra từ phản ứng của KClO3 và MnO2
- Hiện tượng: Que đóm đang cháy bỗng vụt tắt
- Giải thích: Khí N2 không duy trì sự cháy 4 NH3 + 3O2 → 2N2 + 6 H2O
Tác dụng với Clo
2NH3 + 3Cl2 → N2 + 6HCl
Nếu NH3 dư : NH3 + HCl → NH4Cl (khói trắng)
* Kết luận: Amoniac có các tính chất hoá học cơ bản: tính bazơ yếu và tính khử
d. Ứng dụng
- Sản xuất HNO3
- Sản xuất phân đạm và dd NH3 có thể sử dụng trực tiếp làm phân bón
- Điều chế N2H4 làm nhiên liệu cho tên lửa
- NH3 lỏng dùng làm chất làm lạnh cho thiết bị lạnh
- Sử dụng trong công nghiệp đông lạnh (sản xuất nước đá, bảo quản nông phẩm...)
- Sử dụng trong công nghiệp môi trường (loại bỏ một số khí gây ô nhiễm như SO2...)
e. Điều chế
Trong phòng thí nghiệm
- Đun nóng muối amoni với Ca(OH)2 hay dd kiềm:
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 +2H2O
- Để làm khô khí, ta cho khí NH3 có lẫn hơi nước qua bình vôi sống CaO.
- Điều chế nhanh 1 lượng nhỏ khí NH3, ta đun nóng dung dịch NH3 đậm đặc.
Trong công nghiệp
N2 + 3H2 ⇔ 2NH3 (đk: 450 - 500oC), Fe, 200-300 atm)
- Nhiệt độ: 450 – 5000C
- Áp suất: 200- 300 atm
- Chất xúc tác: Fe/Al2O3, K2O
1.2. MUỐI AMONI
Muối amoni là chất tinh thể ion gồm cation amoni NH4+ và anion gốc axít.
Ví dụ: NH4Cl, (NH4)2SO4 , (NH4)2CO3
a. Tính chất vật lý
- Tinh thể
- Đều tan trong nước
- Ion NH4+ không màu
b. Tính chất hoá học
Tác dụng với bazơ kiềm
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3 + 2H2O.
Phương trình ion thu gọn: NH4+ + OH- → NH3 + H2O
→ Điều chế NH3 trong Phòng thí nghiệm và nhận biết muối amoni.
Phản ứng nhiệt phân
- Muối amoni tạo bởi axít không có tính oxi hoá: (HCl,H2CO3) → NH3
NH4Cl (r) → NH3 (k) + HCl (k).
(NH4)2CO3 (r) → NH3 (k) + NH4HCO3(r).
NH4HCO3 (r) → NH3(k) + CO2(k) + H2O
(NH4)2CO3; NH4HCO3 ở nhiệt độ thường cũng tự phân huỷ; ở nhiệt độ cao phản ứng xảy ra nhanh hơn; Dùng NH4HCO3 trong bột nở.
- Muối amoni tạo bởi axít có tính oxi hoá:
(HNO2, HNO3) → N2 , N2O
NH4NO2 → N2 + 2H2O
NH4NO3 → N2O + 2H2O
2. Bài tập minh họa
2.1. Dạng 1: Hiệu suất trong tổng hợp NH3
Bài 1: Để điều chế 68g NH3 cần lấy bao nhiêu lít N2 và H2 ở đktc. Biết hiệu suất phản ứng là 20%.
Hướng dẫn giải
N2 + 3H2 ⇌ 2NH3
Vì hiệu suất phản ứng (1) là 20% nên thực tế cần :
Thể tích N2 (đktc) là : 2.22,4/20% = 22,4 lít
Thể tích H2 (đktc) là : 6.22,4/20% = 672 lít
Bài 2: Trong bình phản ứng có chứa hỗn hợp khí A gồm 10 mol N2 và 40 mol H2 ở nhiệt đô 00C và 10 atm. Sau khi Phản ứng tổng hợp NH3, lại đưa bình về 00C. Biết rằng có 60% hidro tham gia phản ứng
a) Tính số mol các khí trong bình sau phản ứng.
b) Tính áp suất trong bình sau phản ứng
Hướng dẫn giải
Phản ứng tổng hợp NH3 xảy ra theo tỉ lệ :
nN2 : nH2 = 1 : 3
Bài cho : nN2 : nH2 = 10 : 40 = 1 : 4. Vậy H2 dư nhiều hơn.
Phải dựa vào số mol N2 phản ứng để tính số mol NH3 :
a) Phương trình phản ứng :
N2 + 3H2 ⇌ 2NH3
Số mol ban đầu: 10 40 0 mol
Số mol phản ứng: 8 24 16 mol
Số mol sau pư: 2 16 16 mol
Vậy số mol các khi trong bình sau phản ứng là : 4 mol N2 ; 16 mol H2 ; 12 mol NH3.
2 + 16 + 16 = 34 mol
b) Tổng số mol khí trong bình ban đầu : 10 + 40 = 50 mol
Vì PV + nRT mà ở đây VB, TB không đổi, nên ta có
Ps/Pđ = ns/nđ → ps = 34.10/50 = 6,8 atm
2.2. Dạng 2: Phản ứng tạo phức của NH3
Bài 1: Cho lượng khí NH3 đi từ từ qua ống sứ chứa 3,2g CuO nung nóng đến khi phản ứng xảy ra hoàn toàn ; thu được rắn A và 1 hỗn hợp khí B. Chất rắn A phản ứng vừa đủ với 20 ml HCl 1M.
a. Viết ptpư.
b. Tính thể tích khí N2 (đkc) tạo thành sau phản ứng.
Hướng dẫn giải
a. 2NH3 + 3CuO → 3Cu + N2↑ + 3H2O
Chất rắn A: Cu và CuO dư
CuO + 2HCl → CuCl2 + H2O
b. nCuO = nHCl/2 = 0,02/2 = 0,01 mol
số mol CuO tham gia phản ứng khử là: 3,2/80 – 0,01 = 0,03 mol
→ VN2 = 0,01. 22,4 = 2,24 lít
Bài 2: Thổi từ từ NH3 đến dư vào 400 gam dung dịch CuCl2 6,75%
a. Khi lượng kết tủa thu được cực đại thì thể tích NH3 (đktc) đã dùng là bao nhiêu?
b. Khi kết tủa tan hết thì thể tích NH3 (đktc) đã dùng là bao nhiêu?
Hướng dẫn giải
nCuCl2 = 400.6,75/100.135 = 0,2 mol
Phương trình phản ứng: CuCl2 + 2NH3 + 2H2O → Cu(OH)2↓ + 2NH4Cl (1)
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (2)
a. Khi lượng kết tủa cực đại thì chỉ xảy ra phản ứng (1)
→ nNH3 = 0,2.2 = 0,4 mol → VNH3 = 0,4. 22,4 = 8,96 lít
b. Khi kết tủa tan hết xảy ra cả phản ứng (1) và phản ứng (2)
nNH3 = 0,2.2 + 0,2.4 = 1,2 mol → VNH3 = 1,2. 22,4 = 26,88 lít
2.3. Dạng 3: Phản ứng muối amoni
Bài 1: Cho 23,9g hh X gồm NH4Cl và (NH4)2SO4 tác dụng hết với xút, đun nóng thu được 8,96 lít khí (đkc)
a. Tính % khối lượng mỗi chất trong dd X.
b. Cho 4,78g hh X tác dụng với BaCl2 có dư. Tính khối lượng kết tủa thu được
Hướng dẫn giải
a.Phương trình phản ứng:
NH4Cl + NaOH → NH3↑ + NaCl + H2O
(NH4)2SO4 + 2NaOH → 2NH3↑ + Na2SO4 + H2O
Ta có : 53,5x + 132y = 23,9 (1); x + 2y = 0,4 (2)
Từ 1, 2 ta có; x = 0,2 và y = 0,1.
%mNH4Cl = 0,2.53,5/23,9 = 44,77%
→ %m(NH4)2SO4 = 55,23 %
b. Trong 4,78 gam hỗn hợp X → n(NH4)2SO4 = 0,02 mol
→ nBaSO4 = 0,02.233 = 4,46 gam
Bài 2: Hỗn hợp A gồm 2 muối NH4Cl và NH4NO3 được chia thành 2 phần bằng nhau:
Phần 1: Tác dụng hết với AgNO3 thu được 14,35 gam kết tủa.
Phần 2: Đun nóng với NaOH 0,5M tạo thành 6,72 lít khí (đkc)
a.Tính khối lượng hh A.
b.Tính thể tích NaOH cần dùng.
Hướng dẫn giải
Phương trình phản ứng:
NH4Cl + AgNO3 → NH4NO3 + AgCl↓
NH4Cl + NaOH → NH3↑ + NaCl + H2O
NH4NO3 + NaOH → NH3↑ + NaNO3 + H2O
nNH4Cl = nAgCl = 14,35/143,5 = 0,1 mol
nNH4NO3 = 0,3-0,1 = 0,2 mol
a.Khối lượng hỗn hợp A:
mA = 2.(0,1.53,5 + 0,2.80) = 21,35 gam
b. Thể tích NaOH cần dung ở phần 2 là:
V = 0,3/0,5 = 0,6 lít
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Cho 30 lít khí nitơ tác dụng với 30 lít H2 trong điều kiện thích hợp và tạo ra một thể tích NH3 là (các thể tích đo ở cùng điều kiện và hiệu suất phản ứng đạt 30%)?
Câu 2: Để điều chế ra 2 lít NH3 từ N2 và H2 với hiệu suất 25% thì cần thể tích N2 ở cùng điều kiện là?
Câu 3: Thổi từ từ NH3 đến dư vào 300 gam dung dịch AgNO3 8,5%. Khi kết tủa tan hết thì thể tích NH3 (đktc) đã dùng là?
Câu 4: Cho dd NH4NO3 tác dụng vừa đủ với dd hiđroxit của kim loại R (to), thu được 4,48 lit khí (đktc) và dung dịch X. Cô cạn dd X thu được 26,1 gam muối khan. Kim loại R là?
Câu 5: Cho dd (NH4)2SO4 20% vừa đủ vào cốc đựng 800 gam dd Ba(OH)2 8,55% (to). Phản ứng hoàn toàn, trong cốc có m gam chất lỏng (bỏ qua sự bay hơi của nước). Giá trị của m là?
3.2. Bài tập trắc nghiệm
Câu 1: Khi cho NH3 vào bình clo, lửa bùng cháy kèm theo "khói" trắng bay ra. "khói" trắng đó là:
A. NH4Cl
B. HCl
C. N2
D. Cl2
Câu 2: Cho từ từ đến dư NH3 vào dd FeCl3, ZnCl2, AlCl3, CuCl2. Lấy kết tủa đem nung đến khối lượng không đổi được chất rắn X. Cho CO dư đi qua X nung nóng thì chất rắn thu được chứa:
A. ZnO, Cu, Fe.
B. ZnO, Cu, Al2O3, Fe
C. Al2O3, ZnO, Fe
D. Al2O3, Fe.
Câu 3: Nhỏ từ từ dd NH3 cho đến dư vào ống nghiệm đựng dd CuSO4. Hiện tượng quan sát được là:
A. Dd màu xanh thẫm tạo thành
B. Có kết tủa màu xanh lam tạo thành
C. Có kết tủa màu xanh lam tạo thành và có khí màu nâu đỏ thoát ra.
D. Lúc đầu có kết tủa màu xanh lam, sau đó kết tủa tan dần tạo thành dd màu xanh thẫm.
Câu 4: Phương trình phản ứng nào sau đây không thể hiện tính khử của NH3?
A. 4NH3 + 5O2 → 4NO↑ + 6H2O
B. NH3 + HCl → NH4Cl
C. 8NH3 + 3Cl2 → N2↑ + 6NH4Cl
D. 2NH3 + 3CuO → 3Cu + N2↑+ 3H2O
Câu 5: Hiện tượng nào xảy ra khi dẫn khí NH3 đi qua ống đựng bột CuO nung nóng
A. Bột CuO từ màu đen sang màu trắng.
B. Bột CuO từ màu đen sang màu đỏ, có hơi nước ngưng tụ.
C. Bột CuO từ màu đen sang màu xanh, có hơi nước ngưng tụ.
D. Bột CuO không thay đổi màu.
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Amoniac và muối amoni Hóa học 11 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Cấu tạo phân tử, tính chất vật lí (tính tan, tỉ khối, màu, mùi), ứng dụng chính, amoniac trong phòng thí nghiệm và trong công nghiệp.
- Tính chất hoá học của amoniac: Tính bazơ yếu (tác dụng với nước, dung dịch muối, axit) và tính khử (tác dụng với oxi, clo).
- Cách điều chế NH3. Tính chất vật lí (trạng thái, màu sắc, tính tan).
- Tính chất hoá học (phản ứng với dung dịch kiềm, phản ứng nhiệt phân) và ứng dụng của muối amoni.
Tham khảo thêm
- doc Hoá học 11 Bài 7: Nitơ
- doc Hoá học 11 Bài 9: Axit nitric và muối nitrat
- doc Hoá học 11 Bài 10: Photpho
- doc Hoá học 11 Bài 11: Axit photphoric và muối photphat
- doc Hoá học 11 Bài 12: Phân bón hóa học
- doc Hoá học 11 Bài 13: Luyện tập
- doc Hoá học 11 Bài 14: Bài thực hành 2 Tính chất của một số hợp chất nitơ, photpho



