Hoá học 11 Bài 16: Hợp chất của cacbon
Nội dung bài Hợp chất của cacbon tìm hiểu về Tính chất vật lí của CO và CO2; Tính chất vật lí, tính chất hóa học của muối cacbonat (nhiệt phân, tác dụng với axit). Cách nhận biết muối cacbonat bằng phương pháp hoá học. Giúp học sinh hiểu được: CO có tính khử (tác dụng với oxit kim loại), CO2 là một oxit axit, có tính oxi hóa yếu (tác dụng với Mg, C).
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Cacbon monoxit
a. Tính chất vật lý
- Là chất khí không màu, không mùi, không vị
- Hơi nhẹ hơn không khí, ít tan trong nước
- Hóa lỏng ở -191,50C, hóa rắn ở -205,50C, rất bền với nhiệt
- CO là khí rất độc
b. Tính chất hóa học
CO là oxít không tạo muối (oxít trung tính)
Ở to thường, không tác dụng với H2O, axít, kiềm.
Tính khử
CO cháy trong oxi hoặc không khí: 2CO + O2 → 2CO2
Tác dụng với nhiều oxít kim loại (đứng sau Al)
3CO + Fe2O3 → 3CO2 + 2Fe
c. Điều chế
Trong Phòng thí nghiệm
HCOOH → CO + H2O (đk: H2SO4 đặc)
Trong công nghiệp
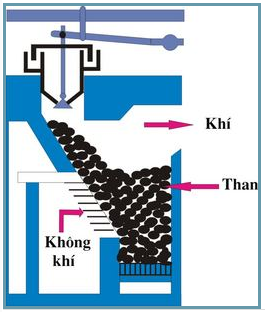
C + H2O CO + H2 (khí than ướt)
CO2 + C → 2CO (khí than khô)
1.2. Cacbon đioxit
a. Tính chất vật lý
- Chất khí, không màu, nặng gấp 1,5 lần không khí
- Tan không nhiều trong nước
- Ở trạng thái rắn, CO2 tạo thành một khối trắng gọi là "nước đá khô". Nước đá khô không nóng chảy mà thăng hoa, dùng để tạo môi trường lạnh, không có hơi ẩm.
b. Tính chất hóa học
CO2 là khí không duy trì sự sống và sự cháy.
CO2 là oxít axít
- Tan trong nước tạo H2CO3.
CO2(k) + H2O(l) → H2CO3 (dd).
- Tác dụng với dung dịch bazơ:
CO2 + Ca(OH)2 → CaCO3 + H2O (Nhận biết CO2)
2CO2 + Ca(OH)2 → Ca(HCO3)2
c. Điều chế
Trong Phòng thí nghiệm
CaCO3 +2HCl → CaCl2+CO2+ H2O.
Trong Công nghiệp
CaCO3 → CaO + CO2
1.3. Axit Cacbonic và muối Cacbonat
a. Axít cacbonic
- H2CO3 là axít 2 nấc rất yếu, kém bền phân huỷ thành CO2 và H2O.
H2CO3 ⇔ H+ + HCO3-
HCO3- ⇔ H+ + CO32-
- Tác dụng với dd kiềm → muối
+ Trung hoà: Na2CO3, CaCO3…
+ Axít: NaHCO3, Ca(HCO3)2…
b. Muối cacbonat
Tính chất
- Tính tan
+ Muối cacbonat của kim loại kiềm, amoni và đa số các muối hidrocacbonat đều tan trong nước
+ Muối cacbonat của kim loại khác không tan trong nước
- Tác dụng với axít (Nhận biết muối cacbonat)
NaHCO3 + HCl → NaCl + CO2 + H2O
HCO3- + H+ →CO2 + H2O
Na2CO3 + 2HCl → NaCl+CO2 + H2O
CO32- + 2H+ → CO2 + H2O
Video 1: Phản ứng giữa NaHCO3 và dung dịch HCl
- Tác dụng với dung dịch kiềm
Muối hidrocacbonat tác dụng với dd kiềm.
NaHCO3 + NaOH → Na2CO3 + H2O
HCO3- + OH- → CO32- + H2O
- Phản ứng nhiệt phân
Muối cacbonat tan: Không bị nhiệt phân.
Muối cacbonat ko tan → oxít kim loại + CO2.
VD: Mg CO3(r) → MgO(r) + CO2(k)
Muối hidrocacbonat → CO32- + CO2 + H2O.
VD: 2 NaHCO3(r) → Na2CO3(r) + CO2 + H2O
Video 2: Thí nghiệm nhiệt phân muối Natri hidrocacbonat
c. Ứng dụng
CaCO3 là chất bột màu trắng, nhẹ, được dùng làm chất độn trong một số ngành công nghiệp.
2. Bài tập minh họa
2.1. Dạng 1: Bài tập CO2 tác dụng với dung dịch Kiềm
a. Bài toán thuận
Cho chất tham gia hỏi sản phẩm.
- Các PTHH của các phản ứng xảy ra
CO2 + OH- → HCO3-
CO2 + 2OH- → CO32- + H2O
Đặt T = nOH- / nCO2 :
+ Nếu T ≤ 1 → tạo muối duy nhất HCO3-
+ Nếu 1 < T < 2 → tạo hỗn hợp hai muối HCO3- và CO32-
+ Nếu T ≥ 2 → tạo muối duy nhất CO32-
- Xác định sản phẩm nào được tạo thành bằng các tính giá trị T.
- Nếu tạo thành hỗn hợp hai muối thường ta giải bằng cách lập hệ PT hoặc sử dụng bảo toàn nguyên tố.
Lưu ý: Có những bài toán không thể tính T. Khi đó phải dựa vào những dữ kiện phụ để tìm ra khả năng tạo muối.
- Hấp thụ CO2 vào NaOH dư (KOH dư) chỉ tạo muối trung hòa Na2CO3 (K2CO3)
- Hấp thụ CO2 vào NaOH chỉ tạo muối Na2CO3, Sau đó thêm BaCl2 vào thấy kết tủa. Thêm tiếp Ba(OH)2 dư vào thấy xuất hiện thêm kết tủa nữa →Tạo cả 2 muối Na2CO3 và NaHCO3
- Chất hấp thụ vào bình NaOH tăng: m bình tăng = m dd tăng = m chất hấp thụ (CO2 + H2O có thể có )
Hoặc với TH tác dụng với Ca(OH)2 , Ba(OH)2:
- Hấp thụ CO2 vào nước vôi dư thì chỉ tạo muối CaCO3
- Hấp thụ CO2 vào nước vôi trong thấy có kết tủa, thêm NaOH dư vào thấy có kết tủa nữa suy ra có sự tạo cả CaCO3 và Ca(HCO3)2
- Hấp thụ CO2 vào nước vôi trong thấy có kết tủa, lọc bỏ kết tủa rồi đun nóng nước lọc lại thấy kết tủa nữa suy ra có sự tạo cả CaCO3 và Ca(HCO3)2.
- Sự tăng giảm khối lượng dung dịch: Khi cho sản phẩm cháy vào bình Ca(OH)2 hay Ba(OH)2
m bình tăng = m hấp thụ
m dd tăng = m hấp thụ - m kết tủa
m dd giảm = m kết tủa – m hấp thụ
Bài 1: Sục 4,48l khí CO2 (đktc) vào 500ml dd NaOH 0,1M và Ba(OH)2 0,2M. Tính m kết tủa thu được?
Hướng dẫn giải
nCO2 = 0,2 mol, nOH- = 0,25 mol, nBa2+ = 0,1 mol
CO2 + 2OH- → CO32- + H2O
0,125 0,25 → 0,125
CO2 + CO32- + H2O → 2HCO3-
0,075 →0,075 → 1,5
nCO32- = 0,05mol
Ba2+ + CO32- → BaCO3
0,05 0,05
⇒ m↓ = 0,05 . 197 = 9,85g
Bài 2: Cho 1,344 lít khí CO2 (đktc) hấp thụ hết vào 2 lít dung dịch X chứa NaOH 0,04M và Ca(OH)2 0,02M thu được m gam kết tủa. Xác định giá trị của m.
Hướng dẫn giải
nCO2 = 1,344/22,4 = 0,06 mol;
nNaOH = 0,04.2 = 0,08 mol; nCa(OH)2 = 0,02.2 = 0,04 mol ; nOH- = 0,08 + 0,04.2 = 0,16 mol
T= nOH-/nCO2 = 0,16/0,06 = 8/3 ⇒ tạo ra muối CO2-
Phương trình phản ứng:
CO2 + OH- → CO32-
0,06 0,06 mol
CO32- + Ca2+ → CaCO3↓
0,04 0,04 0,04 mol
Khối lượng kết tủa thu được: m = 0,04.100 = 4 gam
b. Bài toán nghịch
Cho x mol CO2 tác dụng với a mol OH- tạo thành b kết tủa ( b mol muối trung hòa). Tìm giá trị x biết a, b.
Hướng dẫn giải
Với bài toán này thì chúng ta chú ý đến giá trị a, b.
- Nếu a = 2b thì bài toán rất đơn giản x = b
- Nếu a > 2b thì bài toán có thể có 2 đáp số vì xảy ra 2 trường hợp
+ Trường hợp 1: OH- dư, tức là chỉ xảy ra phản ứng (2) Vậy x= b
+ Trường hợp 2: Xảy ra cả 2 phản ứng (1), (2): Vậy x= a – b
Bài 1: Thổi V lít khí CO2 (đktc) vào 100ml dd Ca(OH)2 1M thu được 6g kết tủa. Lọc kết tủa đun nóng dd lại thấy có kết tủa nữa. Tìm V?
Hướng dẫn giải
Dd sau phản ứng ↓ ⇒ có Ca(HCO3)2 taọ thành
BTNT Ca 0,1 = 0,06 + nCa(HCO3)2 ⇒ nCa(HCO3)2 = 0,04 mol
nCO2 = nCaCO3 + 2. nCa(HCO3)2 = 0,14 mol
VCO2 = 3,136 l
Bài 2: Cho V lít CO2 ( đktc) tác dụng 500ml dung dịch Ca(OH)2 0,5M tạo thành 10 gam kết tủa . Tính giá trị của V?
Hướng dẫn giải
nOH- = 0,25 mol
nCaCO3 = 0,1 mol
TH1: nCO2 = n↓ = 0,1 mol
Thể tích CO2 tham gia phản ứng là: V = 0,1.22,4 = 2,24 lít
TH2: nCaCO3 < nCa(OH)2 ⇒ tạo thành 2 muối của CO32- và HCO3-
nCO2 = 0,25 – 0,1 = 0,15 ⇒ V = 3,36 lit
Vậy giá trị của V là 2,24 lít hoặc 3,36 lít
2.2. Dạng 2: Bài toán khử oxit kim loại bằng C và CO
Bài 1: Khử 16g hỗn hợp các oxit kim loại: FeO, Fe2O3, Fe3O4, CuO, PbO bằng khí CO ở nhiệt độ cao, khối lượng chất rắn thu được là 11,2 g. Tính thể tích khi CO đã tham gia phản ứng (đktc)
Hướng dẫn giải
Áp dụng ĐLBT khối lượng
nCO2 = nCO = x mol
moxit + mCO = mCR + mCO2
16 + 28x = 11,2 + 44x ⇒ x=0,3
⇒ VCO = 6,72 lit
Bài 2: Dẫn một luồng khí CO dư qua ống sứ đựng Fe3O4 và CuO nung nóng đến khi phản ứng hoàn toàn thu được 2,32 gam hỗn hợp kim loại. Khí thoát ra khỏi bình được dẫn qua dung dịch nước vôi trong dư thu được 5 gam kết tủa. Tính tổng khối lượng 2 oxit trong hỗn hợp đầu.
Hướng dẫn giải
Phương trình phản ứng:
4CO + Fe3O4 → 4CO2↑ + 3Fe
CO + CuO → CO2↑ + Cu
CO2 + Ca(OH)2 → CaCO3↓ + H2O
nCO2 = nCaCO3 = 5/100 = 0,05 mol
Áp dụng định luật bảo toàn nguên tố C ta có: nCO = nCO2 = 0,05 mol
Áp dụng định luật bảo toàn khối lượng ta có: moxit kl + mCO = mkl + mCO2
⇒ moxit kl = 2,32 + 0,05.44 – 0,05,28 = 3,12 gam
2.3. Dạng 3: Bài tập về muối Cacbonat
Bài 1: Có hỗn hợp A gồm 3 muối NH4HCO3, NaHCO3 và Ca(HCO3)2. Khi nung 48,8 gam hỗn hợp đó đến khối lượng không đổi thu được 16,2 chất rắn X. Cho X tác dụng với dung dịch axít HCl thu được 2,24 lít (đktc) khí. Xác định khối lượng của mỗi muối trong hỗn hợp A.
Hướng dẫn giải
Gọi số mol của NH4HCO3, NaHCO3 và Ca(HCO3)2 lần lượt là x, y, z mol
Ta có : 79x + 84y + 162z = 48,8 (1)
Phương trình hóa học:
NH4HCO3 → NH3 + CO2 ↑ + H2O
2NaHCO3 → Na2CO3 + CO2 ↑ + H2O
y………………..y/2
Ca(HCO3)2 → CaO + 2CO2 ↑+ H2O
z……………..z
Chất rắn Y gồm: Na2CO3, CaO ⇒ 106y/2 + 56z = 16,2 (2)
Chất rắn Y tác dụng với HCl:
Phương trình phản ứng:
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
y…………………………….y
CaO + 2HCl → CaCl2 + H2O
Ta có : y = 0,1 mol (3)
Từ 1, 2, 3 ta có : x = 0,11; y = 0,1 và z = 0,19
Khối lượng mỗi muối trong hỗn hợp A là:
mNH4HCO3 = 0,11.79 = 8,69 gam
mNaHCO3 = 0,1.162 = 16,2 gam
mCaO = 0,19.56 = 10,64 gam
Bài 2: Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Tính giá trị của V?
Hướng dẫn giải
nHCl = 0,2.1 = 0,2 mol; nNa2CO3 = 1,5.0,1 = 0,15 mol; nKHCO3 = 1.0,1 = 0,1 mol
Phương trình hóa học:
CO32- + H+ → HCO3-
HCO3- + H+ → CO2 + H2O
Vậy thể tích khí CO2 thoát ra là: V = 0,05.22,4 = 0,112 lít
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Thổi V lít khí CO2 (đktc) vào 100ml dd Ca(OH)2 thu được 6g kết tủa. Lọc kết tủa đun nóng dd lại thấy có 4 gam kết tủa nữa. Giá trị của V là?
Câu 2: Cho luồng khí CO (dư) đi qua 56 gam hỗn hợp X gồm CuO và MgO nung nóng đến khi phản ứng hoàn toàn, thu được 49,6 gam chất rắn. Khối lượng CuO có trong hỗn hợp X là?
Câu 3: Khử hoàn toàn một oxit sắt X ở nhiệt độ cao cần vừa đủ V lít khí CO (ở đktc), sau phản ứng thu được 33,6 gam Fe và 17,92 lít khí CO2 (đktc). Công thức của X và giá trị V lần lượt là?
Câu 4: Hấp thụ hoàn toàn 27,552 lít (đktc) CO2 vào m gam dd Ba(OH)2 34,2%, phản ứng hoàn toàn thu được 175,33 gam kết tủa. Giá trị m là?
Câu 5: Nhiệt phân hoàn toàn m gam hỗn hợp X gồm (MgCO3, BaCO3, CaCO3, CuCO3), sau phản ứng thu được 100 gam hỗn hợp các oxit và V lít CO2 (đktc). Sục toàn bộ V lít CO2 (đktc) vào nước vôi trong dư thu được 89 gam kết tủa. Giá trị của m là?
3.2. Bài tập trắc nghiệm
Câu 1: Trong các phản ứng hoá học sau, phản ứng nào sai?
A. 3CO + Fe2O3 −tº→ 3CO2↑ + 2Fe
B. CO + Cl2 → COCl2
C. 3CO + Al2O3 −tº→ 2Al + 3CO2↑
D. 2CO + O2 −tº→ 2CO2↑
Câu 2: Nhóm gồm các khí đều cháy được (pứ với oxi) là:
A. CO, CO2.
B. CO, H2.
C. O2, CO2.
D. Cl2, CO.
Câu 3: Sục khí CO2 vào dd nước vôi trong, hiện tượng xảy ra:
A. Có kết tủa ngay, lượng kết tủa tăng dần qua một cực đại rồi sau đó tan trở lại hết.
B. Một lúc mới có kết tủa, lượng kết tủa tăng dần qua một cực đại rồi lại giảm.
C. Có kết tủa ngay, nhưng kết tủa tan trở lại ngay sau khi xuất hiện.
D. Có kết tủa ngay, lượng kết tủa tăng dần đến một giá trị không đổi.
Câu 4: Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào dung dịch nước vôi trong có chứa 0,25 mol Ca(OH)2. Sản phẩm muối thu được sau phản ứng gồm?
A. Chỉ có CaCO3
B. Chỉ có Ca(HCO3)2
C. Cả CaCO3 và Ca(HCO3)2
D. Không có cả 2 chất CaCO3 và Ca(HCO3)2
Câu 5: Hấp thụ hoàn toàn 2,24 lít (đkc) CO2 vào 100ml dung dịch gồm K2CO3 0,2M và KOH x mol/lít. Sau khi các phản ứng xảy ra hoàn toàn được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 dư được 11,82 gam kết tủa. Giá trị x là
A. 1,0
B. 1,4
C. 1,2
D. 1,6
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Hợp chất của cacbon Hóa học 11 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Tính chất vật lí của CO và CO2
- Tính chất vật lí, tính chất hóa học của muối cacbonat (nhiệt phân, tác dụng với axit).
- Cách nhận biết muối cacbonat bằng phương pháp hoá học.
Tham khảo thêm
- doc Hoá học 11 Bài 15: Cacbon
- doc Hoá học 11 Bài 17: Silic và hợp chất của silic
- doc Hoá học 11 Bài 18: Công nghiệp silicat
- doc Hoá học 11 Bài 19: Luyện tập Tính chất hóa học của cacbon, silic và các hợp chất của chúng



