Hoá học 10 Bài 15: Hóa trị và số oxi hóa
Nội dung bài giảng Hóa trị và số oxi hóa đi sâu tìm hiểu về cách xác định hóa trị của một nguyên tố trong hợp chất ion và hợp chất cộng hóa trị như thế nào? Số oxi hóa là gì? Xác định số oxi hóa bằng cách nào?
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Hóa trị
a. Hóa trị trong hợp chất ion
Trong các hợp chất ion , hóa trị của 1 nguyên tố bằng điện tích của ion và được gọi là điện hóa trị của nguyên tố đó.
Ví dụ: Trong hợp chất NaCl , Na có điện hóa trị 1+ và Cl có điện hóa trị 1– . Trong hợp chất CaF2, Ca có điện hóa trị 2+ và F có điện hóa trị 1–
Người ta quy ước , khi viết điện hóa trị của nguyên tố , ghi giá trị điện tích trước, dấu của điện tích sau
Các nguyên tố kim loại thuộc nhóm IA , IIA , IIIA có số electron ở lớp ngoài cùng là 1, 2, 3 có thể nhường nên có điện hóa trị là 1+ , 2+ , 3+
Các nguyên tố phi kim thuộc nhóm VIA , VIIA nên có 6, 7 electron lớp ngoài cùng , có thể nhận thêm 2 hay 1 electron vào lớp ngoài cùng , nên có điện hóa trị 2– , 1–
b. Hóa trị trong hợp chất cộng hóa trị
Quy tắc : Trong các hợp chất cộng hóa trị, hóa trị của 1 nguyên tố được xác định bằng số liên kết cộng hóa trị của nguyên tử nguyên tố đó trong phân tử và được gọi là cộng hóa trị của nguyên tố đó.
Ví dụ: Hoá trị các nguyên tố trong phân tử nước và metan
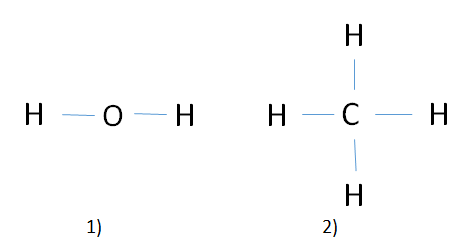
⇒ Trong H2O : Nguyên tố H có cộng hóa trị 1 , nguyên tố O có cộng hóa trị 2
⇒ Trong CH4 : Nguyên tố C có cộng hóa trị hóa trị 4 , nguyên tố H có cộng hóa trị 1
1.2. Số oxi hóa
a. Khái niệm
Số oxi hóa của 1 nguyên tố trong phân tử là điện tích của nguyên tử nguyên tố đó trong phân tử , nếu giả định rằng mọi liên kết trong phân tử đều là liên kết ion.
b. Các quy tắc xác định số oxi hóa
Quy tắc 1: Số oxi hóa của các nguyên tố trong các đơn chất bằng không
Quy tắc 2: Trong 1 phân tử, tổng số số oxi hóa của các nguyên tố bằng 0
Quy tắc 3: Số oxi hóa của các ion đơn nguyên tử bằng điện tích của ion đó . Trong ion đa nguyên tử , tổng số số oxi hóa của các nguyên tố bằng điện tích của ion
Quy tắc 4: Trong hầu hết các hợp chất, số oxi hóa của H bằng +1 , trừ 1 số trường hợp như hidro, kim loại (NaH , CaH2 ….) . Số oxi hóa của O bằng –2 trừ trường hợp OF2 , peoxit (chẳng hạn H2O2 , …)
c. Ví dụ
Thí dụ: Trong phân tử đơn chất Fe, Zn, H2, O2 thì số oxi hóa của các nguyên tố đều bằng không
Thí dụ: Trong SO2 , số oxi hóa của O là -2 → Số oxi hóa của S là +4
Trong H2S, số oxi hóa của H là +1 → Số oxi hóa của S là -2
Trong H2SO4, số oxi hóa của O là -2, số oxi hóa của H là +1 → Số oxi hóa của S là +6
Thí dụ: Số oxi hóa của các nguyên tố ở các ion K+ , Ca2+, Cl– S2– lần lượt là +1 , +2 , –1 , –2
Thí dụ:
Số oxi hóa của N trong ion NH4+ là x
x.1 + 4(+1) = +1 ⇒ x = -3
Số oxi hóa của N trong ion NO3– là x
x + 3(–2) = –1 ⇒ x =+5
2. Bài tập minh họa
Bài tập về hóa trị và số oxi hóa
Phương pháp giải
Đối với hợp chất hữu cơ, số oxi hóa của C trong HCHO được tính là số oxi hóa trung bình; hoặc xem số oxi hóa của C là tổng đại số các số oxi hóa của các nguyên tử khác mà nó liên kết.
Chẳng hạn: Trong CH3 – CH2OH:
Số oxi hóa trung bình của C là: -2
Còn số oxi hóa của C trong CH3 là: -3 và trong CH2OH là -1.
Bài 1: Số oxi hóa của nitơ trong NH4+, NO2- , và HNO3 lần lượt là:
A. +5, -3, +3.
B. -3, +3, +5
C. +3, -3, +5
D. +3, +5, -3.
Hướng dẫn giải
Đặt x, y, z lần lượt là số oxi hóa của nguyên tố nitơ trong NH4+, NO2- , và HNO3
Ta có: x + 4.1 = 1 ⇒ x = -3. Số OXH của N trong NH4+là -3
y + 2.(-2) = -1 ⇒ y = 3. Số OXH của N trong NO2- là +3
z + 1 + 3.(-2) = 0 ⇒ z = 5. Số OXH của N trong HNO3 là +5
⇒ Chọn B.
Bài 2: Xác định số oxi hóa của các nguyên tố trong hợp chất, đơn chất và ion sau:
a) H2S, S, H2SO3, H2SO4.
b) HCl, HClO, NaClO2, HClO3.
c) Mn, MnCl2, MnO2, KMnO4.
Hướng dẫn giải
a) Số oxi hóa của S trong các chất lần lượt là: S-2, S0, S+4, S+6
b) Số oxi hóa của Cl trong các hợp chất: Cl-1, Cl+1,Cl+3, Cl+5, Cl+7.
c) Số oxi hóa của Mn trong các chất: Mn0, Mn+2, Mn+4, Mn+7
Bài 3: Hóa trị và số oxi hóa của N trong phân tử NH4Cl lần lượt là
A. 4 và -3
B. 3 và +5
C. 5 và +5
D. 3 và -3
Hướng dẫn giải
N thuộc nhóm IVA nên có hóa trị 4
Số OXH: x + 4.1 + (-1)=0 ⇒ x = -3.
Bài 4: Xác định điện hóa trị của các nguyên tố trong các hợp chất sau: KCl, Na2S; Ca3N2.
Hướng dẫn giải
Hóa trị của một nguyên tố trong hợp chất ion gọi là điện hóa trị và bằng điện tích ion đó.
+) KCl: Điện hóa trị của K là: 1+ và của Cl là: 1-
+) Na2S: Điện hóa trị của Na là: 1+ và của S là: 2-
+) Ca3N2: Điện hóa trị của Ca là: 2+ và của N là: 3-
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Xác định số oxi hóa của các nguyên tố trong các hợp chất, đơn chất và ion sau:
a) H2S, S, K2SO4 , NH4+
b) HCl, HClO, MnO4-, Zn
c) Mn, MnCl2 , MnO2 , PO43-
d) KMnO4 , Fe , H2SO3 , SO42-
Câu 2:
a) Xác định cộng hóa trị và số oxi hóa của các chất sau đây: N2, Cl2, H2O
b) Xác định điện hóa trị và số oxi hóa của các chất sau: NaCl, AlCl3
Câu 3: Trong hợp chất CH4 cộng hóa trị của C là?
Câu 4: Số oxi hóa của Nitơ trong NH4+, NO2- và HNO3 lần lượt là?
Câu 5: Trong phản ứng: 2H2S + O2 → 2S + 2H2O. Số oxi hóa của S trong H2S và S lần lượt là:
3.2. Bài tập trắc nghiệm
Câu 1: Hóa trị và số oxi hóa của N trong phân tử NH4Cl lần lượt là
A. 4 và -3
B. 3 và +5
C. 5 và +5
D. 3 và -3
Câu 2: Dãy các chất nào dưới đây được sắp xếp theo chiều tăng dần số oxi hóa của nitơ?
A. NO, N2O, NH3, NO3-
B. NH4+, N2, N2O, NO, NO2, NO3-
C. NH3, N2, NO2, NO, NO3-
D. NH3, NO, N2O, NO2, N2O5
Câu 3: Cho một số hợp chất: H2S, H2SO3, H2SO4, NaHS, Na2SO3, SO3, K2S, SO2. Dãy các chất trong đó lưu huỳnh có cùng số oxi hóa là
A. H2S, H2SO3, H2SO4
B. H2SO3, H2SO4, Na2SO3, SO3
C. H2SO3, H2SO4, Na2SO3, SO2
D. H2S, NaHS, K2S
Câu 4: Số oxi hóa của nguyên tố Mn trong hợp chất K2MnO4 là:
A. +7
B. 7+
C. +6
D. 6+
Câu 5: Nhận định nào chưa chính xác về số oxi hóa:
A. Đơn chất luôn có số oxi hóa bằng 0
B. Trong hợp chất, tổng số oxi hóa của các nguyên tố bằng 0
C. Trong hợp chất, kim loại luôn có số oxi hóa dương bằng hóa trị của chúng
D. Trong hợp chất, phi kim luôn có số oxi hóa âm và giá trị bằng hóa trị của chúng
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Hóa trị và số oxi hóa Hóa học 10 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Điện hoá trị, hóa trị của nguyên tố trong hợp chất ion, trong hợp chất cộng hóa trị
- Số oxi hoá của nguyên tố trong các phân tử đơn chất và hợp chất.
- Những quy tắc xác định số oxi hoá của nguyên tố.
Tham khảo thêm
- doc Hoá học 10 Bài 12: Liên kết ion - Tinh thể ion
- doc Hoá học 10 Bài 13: Liên kết cộng hóa trị
- doc Hoá học 10 Bài 14: Tinh thể nguyên tử và tinh thể phân tử
- doc Hoá học 10 Bài 16: Luyện tập Liên kết hóa học



