Hoá học 10 Bài 7: Bảng tuần hoàn các nguyên tố hóa học
Nội dung bài học Bảng tuần hoàn các nguyên tố hóa học tìm hiểu về Cấu tạo bảng tuần hoàn: ô lượng tử, chu kì, nhóm nguyên tố. Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
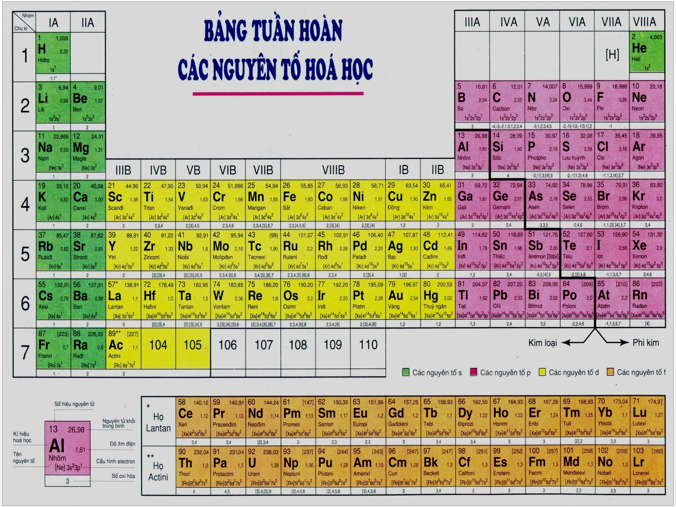
- Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được sắp xếp thành một hàng.
- Các nguyên tố có số electron hóa trị trong nguyên tử như nhau được xếp thành một cột.
1.2. Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
a. Ô nguyên tố
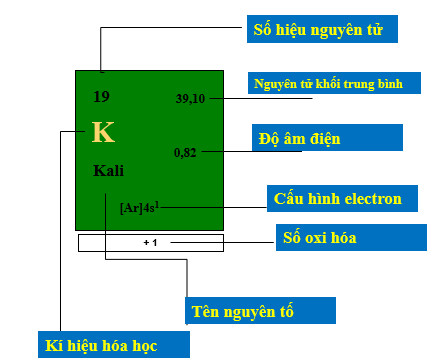
- Số thứ tự nguyên tố = số đơn vị điện tích hạt nhân (Z) = số proton = số electron trong nguyên tử.
b. Chu kì
- Chu kì là dãy các nguyên tố của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần
- Số thứ tự của chu kì bằng số lớp electron trong nguyên tử.
- Bảng tuần hoàn gồm có 7 chu kì
- Chu kì 1:
+ Nguyên tố bắt đầu: H (Z = 1): 1s1
+ Nguyên tố kết thúc: He (Z = 2): 1s2
+ Số nguyên tố: 2
- Chu kì 2:
+ Nguyên tố bắt đầu: Li (Z = 3)
+ Nguyên tố kết thúc: Ne (Z = 10)
+ Số nguyên tố: 8
- Chu kì 3:
+ Nguyên tố bắt đầu: Na (Z = 11)
+ Nguyên tố kết thúc: Ar (Z = 18)
+ Số nguyên tố: 8
- Chu kì 4:
+ Nguyên tố bắt đầu: K (Z = 19)
+ Nguyên tố kết thúc: Kr (Z = 36)
+ Số nguyên tố: 18
- Chu kì 5:
+ Nguyên tố bắt đầu: Rb (Z =37)
+ Nguyên tố kết thúc: Xe (Z = 54)
+ Số nguyên tố: 18
- Chu kì 6:
+ Nguyên tố bắt đầu: Cs (Z = 55)
+ Nguyên tố kết thúc: Rn (Z = 86)
+ Số nguyên tố: 32
- Chu kì 7:
+ Nguyên tố bắt đầu: Fr (Z = 87)
+ Nguyên tố kết thúc: Chưa xác định
+ Số nguyên tố: Chưa hoàn thiện
1.3. Nhóm nguyên tố
Nhóm nguyên tố là gồm các nguyên tố có cấu hình electron lớp ngoài cùng tương tự nhau, nên tính chất hóa học gần giống nhau được xếp thành một cột.
Nhóm nguyên tố
- Nhóm A: nsanpb
Với a, b là số electron trên phân lớp s và p. Số thứ tự của nhóm bằng tổng số electron lớp ngoài cùng: a + b
1 ≤ a ≤ 2 và 0 ≤ b ≤ 6
- Nhóm B: (n – 1)dansb
Với b = 2, 0 ≤ a ≤ 10 → Các nguyên tố nhóm B là tập hợp các nguyên tố có electron hóa trị nằm trên phân lớp d và f.
2. Bài tập minh họa
2.1. Dạng 1: Mối liên hệ giữa vị trí với cấu tạo nguyên tử, nguyên tố, tính chất hợp chất
Bài 1: Cho nguyên tử các nguyên tố X1, X2, X3, X4, X5, X6 lần lượt có cấu hình electron như sau:
X1: 1s22s22p63s2
X2: 1s22s22p63s23p64s1
X3: 1s22s22p63s23p64s2
X4: 1s22s22p63s23p5
X5: 1s22s22p63s23p63d64s2
X6: 1s22s22p63s23p4
Các nguyên tố cùng một chu kì là:
A. X1, X3, X6
B. X2, X3, X5
C. X1, X2, X6
D. X3, X4
Hướng dẫn giải
Các nguyên tố cùng một chu kì thì có cùng số lớp electron
⇒ Đáp án B
Bài 2: Giả sử nguyên tố M ở ô số 19 trong bảng tuần hoàn chưa được tìm ra và ô này vẫn còn được bỏ trống. Hãy dự đoán những đặc điểm sau về nguyên tố đó:
a. Tính chất đặc trưng.
b. Công thức oxit. Oxit đó là oxit axit hay oxit bazơ?
Hướng dẫn giải
a. Cấu hình electron của nguyên tố đó là: 1s22s22p63s23p64s1
⇒ Tính chất đặc trưng của M là tính kim loại.
b. Nguyên tố đó nằm ở nhóm IA nên công thức oxit là M2O. Đây là một oxit bazơ.
Bài 3: Nguyên tử R tạo được Cation R+. Cấu hình e của R+ ở trạng thái cơ bản là 3p6. Tổng số hạt mang điện trong R là.
A.18
B.22
C.38
D.19
Hướng dẫn giải
Cấu hình của R+ là 3p6
⇒ của R sẽ là 3p64s1
⇒ R có cấu hình đầy đủ là 1s22s22p63s23p64s1
⇒ Tổng hạt mang điện trong R là ( p + e ) = 38
⇒ Đáp án C
2.2. Dạng 2: Xác định nguyên tố thông qua nguyên tử khối
Bài 1. Cho 10 gam kim loại A (thuộc nhóm IIA) tác dụng với nước, thu được 6,11 lit khí hiđro (đo ở 25oC và 1 atm).
a. Hãy xác định tên của kim loại M đã dùng.
b. Cho 4 gam kim loại A vào cốc đựng 2,5lit dung dịch HCl 0,06M thu được dung dịch B.
Hướng dẫn giải
A + 2H2O → A(OH)2 + H2
a a
Số mol khí H2 = 0,25 (mol) ⇒ a = 0,25
Ta có: MA = 10/0,25 = 40 (Ca).
b. Số mol Ca = 4/40 = 0,1 mol. Các phương trình phản ứng:
Ca + 2HCl → CaCl2 + H2
(mol): 0,075 0,15 0,075
Ca + 2H2O → Ca(OH)2 + H2
(mol): 0,025 0,025
Dung dịch B gồm: CaCl2 = 0,075 mol và Ca(OH)2 = 0,025 mol.
2.3. Dạng 3: Xác định hai nguyên tố thuộc cùng 1 nhóm A
Cho 24,95 gam một hỗn hợp hai kim loại nằm ở hai chu kì liên tiếp và đều thuộc nhóm IIA của bảng tuần hoàn tác dụng với axit H2SO4 loãng thu được 4,48 lít khí H2 (đktc). Hai kim loại đó là:
A. Ca và Sr
B. Sr và Ba
C. Be và Ca
D. Ca và Ba
Hướng dẫn giải
Gọi công thức chung của hai kim loại thuộc nhóm IIA là M
Có phản ứng: M + H2SO4 → MSO4 + H2
→ nM = nH2 = 0,2 → M = 24,95 : 0,2 = 124,75
Do đó hỗn hợp cần có 1 kim loại có M < 124,75 và 1 kim loại có khối lượng mol lớn hơn 124,75.
Mà hai kim loại trong hỗn hợp ở hai chu kì liên tiếp và thuộc nhóm IIA.
Nên hai kim loại đó là Sr và Ba
⇒ Đáp án B
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Hợp chất A được tạo thành từ cation X+ và anion Y2-. Mỗi ion đều do 5 nguyên tử của hai nguyên tố tạo nên. Tổng số proton trong X+ là 11, tổng số electron trong Y2- là 50. Biết rằng hai nguyên tố trong Y2- đều thuộc cùng một nhóm A và thuộc hai chu kì lien tiếp. Phân tử khối của A là?
Câu 2: X và Y là hai nguyên tố thuộc hai nhóm A kế tiếp nhau trong bảng tuần hoàn, ở trạng thái đơn chất X và Y phản ứng được với nhau. Tổng số proton trong hạt nhân nguyên tử của X và Y là 23. Biết rằng X đứng sau Y trong bảng tuần hoàn. X là?
Câu 3: Trong bảng hệ thống tuần hoàn các nguyên tố, số chu kì nhỏ và chu kì lớn là?
Câu 4: Nguyên tố M có số hiệu nguyên tử là 29. M thuộc nhóm nào của bảng tuần hoàn?
3.2. Bài tập trắc nghiệm
Câu 1: R, T, X, Y, Z lần lượt là năm nguyên tố liên tiếp trong bảng tuần hoàn, có tổng số điện tích hạt nhân là 90+. Kết luận nào sau đây đúng?
A. Năm nguyên tố này thuộc cùng một chu kì.
B. Nguyên tử của nguyên tố Z có bán kính lớn nhất trong số các nguyên tử của năm nguyên tố trên.
C. X là phi kim.
D. R có 3 lớp electron.
Câu 2: Nguyên tố M thuộc chu kì 3, nhóm IVA của bảng tuần hoàn. Số hiệu nguyên tử của nguyên tố M là
A. 14
B. 16
C. 33
D. 35
Câu 3: Cho hai nguyên tố L và M có cùng cấu hình electron lớp ngoài cùng là ns2. Phát biểu nào sau đây về M và L luôn đúng?
A. L và M đều là những nguyên tố kim loại.
B. L và M thuộc cùng một nhóm trong bảng tuần hoàn.
C. L và M đều là những nguyên tố s.
D. L và M có 2 electron ở ngoài cùng.
Câu 4: Cho các nguyên tố 8X, 11Y, 20Z và 26T. Số electron hóa trị của nguyên tử các nguyên tố tang dần theo thứ tự:
A. X < Y < Z < T.
B. T < Z < X < Y.
C. Y < Z < X < T.
D. Y < X < Z < T.
Câu 5: A, B, C là các kim loại chuyển tiếp và đều thuộc chu kỳ 4 trong bảng tuần hoàn (ZA < ZB < ZC). Biết rằng tổng số electron lớp ngoài cùng của A, B và C bằng 4; tổng số electron ở lớp ngoài cùng và phân lớp sát ngoài cùng của B là 8. Điều khẳng định nào sau đây về A, B, C là đúng?
A. Tổng số electron của B2+ và C2+ là 51.
B. Công thức oxit cao nhất của A có dạng A2O3.
C. Tổng số khối: MA + MB + MC = 79.
D. Cả A, B, C đều tác dụng được với dung dịch H2SO4 loãng làm giải phóng khí H2.
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Bảng tuần hoàn các nguyên tố hóa học Hóa học 10 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Cấu tạo bảng tuần hoàn: ô lượng tử, chu kì, nhóm nguyên tố.
- Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn.
Tham khảo thêm
- doc Hoá học 10 Bài 8: Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học
- doc Hoá học 10 Bài 9: Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học và Định luật tuần hoàn
- doc Hoá học 10 Bài 10: Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
- doc Hoá học 10 Bài 11: Luyện tập Bảng tuần hoàn, sự biến đổi tuần hoàn cấu hình electron nguyên tử và tính chất của các nguyên tố hóa học



