Giải bài tập SGK Hóa 10 Nâng cao Bài 10: Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các NTHH
Những kiến thức trọng tâm của bài Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học cùng lời giải chi tiết và chính xác cho bài tập 1, 2, 3, 4, 5, 6 trong SGK nâng cao trang 44 đã được eLib sưu tầm và đăng tải trong tài liệu Giải bài tập Hóa 10. Mời các bạn tham khảo chuẩn bị tốt cho bài học sắp tới.
Mục lục nội dung

1. Giải bài 1 trang 44 SGK Hóa 10 nâng cao
Sự biến thiên tính chất của các nguyên tố thuộc chu kì sau lại được lặp lại giống như chu kì trước là do:
A. sự lặp lại tính kim loại của các nguyên tố ở chu kì sau so với chu kì trước.
B. sự lặp lại tính phi kim của các nguyên tố ở chu kì sau so với chu kì trước.
C. sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trước.
D. sự lặp lại tính chất hóa học của các nguyên tố ở chu kì sau so với chu kì trước.
Hãy chọn đáp án đúng.
Phương pháp giải
Để giải bài tập này các em cần nắm được nguyên nhân gây ra sự biến thiên cấu hình electron của các nguyên tố trong bảng tuần hoàn
Hướng dẫn giải
Sự biến thiên tính chất của các nguyên tố thuộc chu kì sau lại được lặp lại giống như chu kì trước là do sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trước.
Đáp án C
2. Giải bài 2 trang 44 SGK Hóa 10 nâng cao
Dựa vào bảng 2.1, hãy cho biết số electron lớp ngoài cùng của nguyên tử các nguyên tố sau đây: H, He, Li, Na, K, Ga, O, S, Cl, Br.
Phương pháp giải
Quan sát bảng sau để trả lời câu hỏi
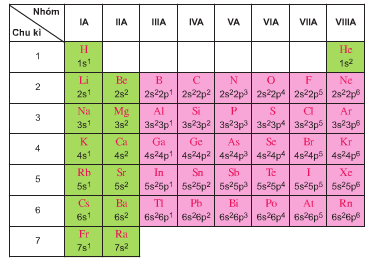
Hướng dẫn giải
H → Số electron lớp ngoài cùng là 1
He → Số electron lớp ngoài cùng là 2
Li → Số electron lớp ngoài cùng là 1
Na → Số electron lớp ngoài cùng là 1
K → Số electron lớp ngoài cùng là 1
Ca → Số electron lớp ngoài cùng là 2
O → Số electron lớp ngoài cùng là 6
S → Số electron lớp ngoài cùng là 6
Cl → Số electron lớp ngoài cùng là 7
Br → Số electron lớp ngoài cùng là 7
3. Giải bài 3 trang 44 SGK Hóa 10 nâng cao
Cho nguyên tử các nguyên tố có: Z = 8, Z = 9, Z = 17, Z = 19. Hãy xác định số electron lớp ngoài cùng của nguyên tử các nguyên tố đó, số thứ tự nhóm và chu kì chứa các nguyên tố đó.
Phương pháp giải
- Viết cấu hình electron của phản ứng → Từ đó xác định số e lớp ngoài cùng, thứ tự, chu kì
Hướng dẫn giải
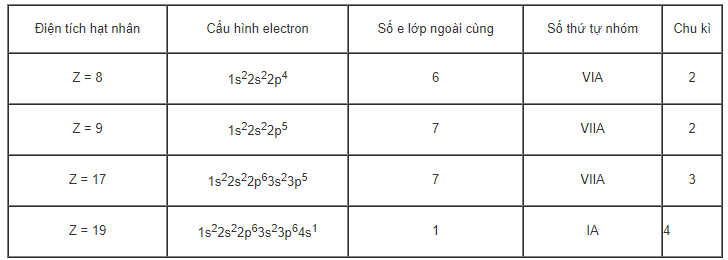
4. Giải bài 4 trang 44 SGK Hóa 10 nâng cao
Viết cấu hình electron nguyên tử của các nguyên tố có Z = 18 và Z = 19. Tại sao nguyên tố có Z = 18 ở chu kì 3, còn nguyên tố có Z = 19 lại ở chu kì 4?
Phương pháp giải
- Viết cấu hình electron của phản ứng → Từ đó xác định chu kì
Hướng dẫn giải
Cấu hình electron của nguyên tố có (Z = 18): 1s22s22p63s23p6
⇒ Nguyên tố này thuộc chu kì 3 vì có 3 lớp electron.
Cấu hình electron của nguyên tố có (Z = 19): 1s22s22p63s23p64s1
⇒ Nguyên tố này thuộc chu kì 4 vì có 4 lớp electron.
5. Giải bài 5 trang 44 SGK Hóa 10 nâng cao
Viết cấu hình electron nguyên tử của các nguyên tố có Z = 20; 21; 24; 29; 30. Cấu hình electron của chúng có đặc điểm gì? Tại sao Cu ở nhóm IB, Zn ở nhóm IIB?
Phương pháp giải
Viết cấu hình theo ba bước sau:
- B1: Điền lần lượt các e vào các phân lớp theo thứ tự tăng dần mức năng lượng.
- B2: Sắp xếp lại theo thứ tự các lớp và phân lớp theo nguyên tắc từ trong ra ngoài.
- B3: Xem xét phân lớp nào có khả năng đạt đến bão hòa hoặc bán bão hòa thì có sự sắp xếp lại các electron ở các phân lớp (chủ yếu là d và f)
Hướng dẫn giải
Cấu hình electron nguyên tử của các nguyên tố:
Z = 20: 1s22s22p63s23p64s2 ;
Z = 21: 1s22s22p63s23p63d14s2 ;
Z = 24: 1s22s22p63s23p63d54s1 ;
Z = 29: 1s22s22p63s23p63d104s1 ;
Z = 30: 1s22s22p63s23p63d104s2 ;
Nguyên tử của nguyên tố Z = 20 có electron cuối cùng điền vào phân lớp s của lớp ngoài cùng. Đó là nguyên tố s.
Các nguyên tử của nguyên tố còn lại có electron cuối cùng điền vào phân lớp d sát lớp ngoài cùng. Đó là những nguyên tố d.
Ở nguyên tử của nguyên tố Z = 24 và Z = 29 có sự chuyển 1 electron từ phân lớp 4s của lớp ngoài cùng để đạt cấu hình bán bão hòa (phân lớp 3d có 5e) và bão hòa (phân lớp 3d có đủ 10e).
Những nguyên tố d có phân lớp d đã bão hòa thì số thứ tự nhóm của chúng bằng số electron lớp ngoài cùng. Vì vậy, nguyên tử của nguyên tố Cu (Z = 29) có phân lớp 3d đủ 10 electron và lớp ngoài cùng có 1 electron nên ở nhóm IB và nguyên tử của nguyên tố Zn (Z = 30) có phân lớp 3d đủ 10 electron và lớp ngoài cùng có 2 electron nên ở nhóm IIB.
6. Bài 6 trang 44 SGK Hóa 10 nâng cao
Sự phân bố electron vào các AO của nguyên tử các nguyên tố C, Ca, Fe và Br sau đây đúng hay sai? Nếu sai hãy sửa lại cho đúng.
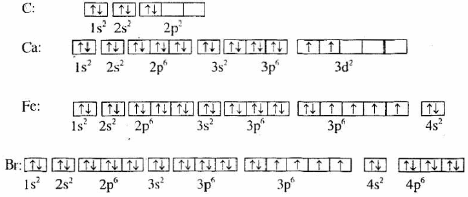
Phương pháp giải
Dựa vào quy tắc Hun và nguyên lí vững bền để giải bài tập
Hướng dẫn giải
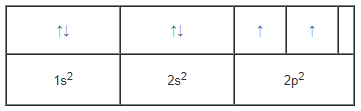
Cấu hình electron nguyên tử của nguyên tố C viết sai. Theo quy tắc Hun, 2 electron ở mức 2p phải phân bố trên 2 obitan 2p. Electron được phân bố như sau:
Mức năng lượng 3d cao hơn 4s nên ở nguyên tố Ca, việc viết cấu hình electron đã vi phạm nguyên lí vững bền. Electron được phân bố như sau:
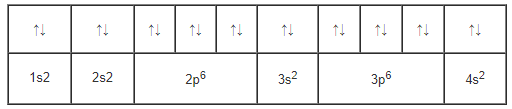
Cấu hình electron nguyên tử của Fe viết đúng.
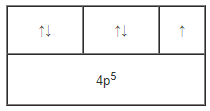
Cấu hình electron nguyên tử của Br viết thừa 1 electron ở phân lớp 4p. Sửa lại như sau:
Tham khảo thêm
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 9: Bảng tuần hoàn các nguyên tố hóa học
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 11: Sự biến đổi một số đại lượng vật lí của các nguyên tố hóa học
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 12: Sự biến đổi tính KL, tính phi kim của các NTHH, định luật tuần hoàn
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 13: Ý nghĩa của bảng tuần hoàn các NTHH
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 14: Luyện tập chương 2



