Giải bài tập SGK Hóa 10 Nâng cao Bài 7: Năng lượng của các electron trong nguyên tử, Cấu hình electron nguyên tử
Dưới đây là Hướng dẫn giải Hóa 10 SGK nâng cao Chương 1 Bài 7 Năng lượng của các electron trong nguyên tử, cấu hình electron nguyên tử được eLib biên soạn và tổng hợp, nội dung bám sát theo chương trình SGK Hóa học 10 nâng cao giúp các em học sinh nắm vững phương pháp giải bài tập và ôn tập kiến thức hiệu quả hơn.
Mục lục nội dung

1. Giải bài 1 trang 32 SGK Hóa 10 nâng cao
Hãy ghép cấu hình electron ở trạng thái cơ bản với nguyên tử thích hợp.
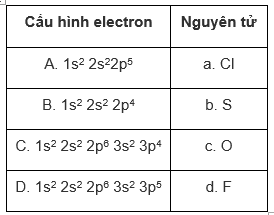
Phương pháp giải
Viết cấu hình electron của mỗi chất rồi tìm phương án phù hợp
Hướng dẫn giải
Ta có:
Cl (Z= 17): 1s22s22p63s23p5
S (Z = 16): 1s22s22p63s23p4
O (Z = 8): 1s22s22p4
F (Z = 9): 1s22s22p5
Vậy: A-d; B - c; C-b; D-a.
2. Giải bài 2 trang 32 SGK Hóa 10 nâng cao
Sự phân bố electron trong nguyên tử tuân theo những nguyên lí và quy tắc gì? Hãy phát biển các nguyên lí và quy tắc đó? Lấy ví dụ minh họa.
Phương pháp giải
Sự phân bố electron trong nguyên tử tuân theo những nguyên lí và quy tắc là: Nguyên lí Pau-li, nguyên lí vững bền, quy tắc Hun.
Hướng dẫn giải
Sự phân bố electron trong nguyên tử tuân theo những nguyên lí và quy tắc là: Nguyên lí Pau-li, nguyên lí vững bền, quy tắc Hun.
- Nguyên lí Pau-li: “Trên một obitan chỉ có thể có nhiều nhất là hai-electron và hai electron này chuyển động tự quay khác chiều nhau xung quanh trục riêng của mỗi electron”.
Ví dụ: ↑↓ 2 electron ghép đôi; ↑: 1 electorn độc thân
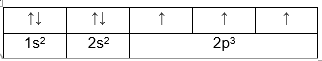
- Nguyên lí vững bền: “Ở trạng thái cơ bản, trong nguyên tử các electron chiếm lần lượt những obitan có mức năng lượng từ thấp đến cao. ”
Ví dụ: Cấu hình e của Cl viết dưới dạng ô lượng tử.
.png)
- Quy tắc Hun: “Trong cùng một phân lớp, các electron sẽ phân bố trên các obitan sao cho số electron độc thân là tối đa và các electron này phải có chiều tự quay giống nhau”.
Ví dụ: Cấu hình e của N viết dưới dạng ô lượng tử
3. Giải bài 3 trang 32 SGK Hóa 10 nâng cao
Tại sao trong sơ đồ phân bố electron của nguyên tử cacbon (C: 1s22s22p2), phân lớp 2p lại biểu diễn như sau:
.png)
Phương pháp giải
- Quy tắc Hun: “Trong cùng một phân lớp, các electron sẽ phân bố trên các obitan sao cho số electron độc thân là tối đa và các electron này phải có chiều tự quay giống nhau”.
Hướng dẫn giải
Theo quy tắc Hun thì sự phân bố electron vào các obitan sao cho số electron độc thân là tối đa nên trong phân lớp 2p của cacbon phải biểu diễn như trên.
4. Giải bài 4 trang 32 SGK Hóa 10 nâng cao
Hãy viết cấu hình electron của các nguyên tử có Z = 20, Z= 21, Z = 22, Z = 24, Z = 29 và cho nhận xét cấu hình electron của các nguyên tử đó khác nhau như thế nào?
Phương pháp giải
Viết cấu hình electron
- Bước 1: Xác định số electron của nguyên tử.
- Bước 2: Các electron được phân bố lần lượt vào các phân lớp theo chiều tăng của năng lượng trong nguyên tử (1s 2s 2p 3s 3p 4s 3d 4p 5s...) và tuân theo quy tắc sau:
+ Phân lớp s chứa tối đa 2 electron
+ Phân lớp p chứa tối đa 6 electron
+ Phân lớp d chứa tối đa 10 electron
+ Phân lớp f chứa tối đa 14 electron.
- Bước 3: Viết cấu hình electron biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
Hướng dẫn giải
Cấu hình electron của các nguyên tử là:
Z = 20: 1s22s22p63s23p64s2.
Z = 21: 1s22s22p63s23p63d14s2 .
Z = 22: 1s22s22p63s23p63d24s2
Z = 24: ls22s22p63s23p63d54s1.
Z = 29: 1s22s22p63s23p63d104s1
Nhận xét:
- Cấu hình Z= 20 khác với các cấu hình còn lại ở chỗ không có phân lớp 3d.
- Cấu hình Z = 24 và Z = 29 đều có 1 electron ở phân lớp 4s.
- Cấu hình Z= 24 và Z = 22 đều có 2 electron ở phân lớp 4s.
- Ở cấu hình của Z = 24, nếu đúng quy luật thí phải là [Ar] 3d44s2, nhưng do phân lớp 3d vội giả bão hòa nửa phân lớp” nên mới có cấu hình như trên.
- Ở cấu hình của Z = 29, nếu đúng quy luật thì phải là [Ar] 3d94s2, nhưng do phân lớp 3d “vội bão hòa” nên mới có cấu hình như trên.
- Ở cấu hình của Z= 29, nếu đúng quy luật thì phải là [Ar] 3d94s2, nhưng do phân lớp 3d “vội bão hòa” nên mới có cấu hình như trên.
5. Giải bài 5 trang 32 SGK Hóa 10 nâng cao
Hãy cho biết số electron lớp ngoài cùng của các nguyên tử H, Li, Na, K, Ca, Mg, C, Si, O
Phương pháp giải
- Viết cấu hình electron → số eletron ngoài cùng
Hướng dẫn giải
Cấu hình electron của các nguyên tử:
H (Z = 1): 1s1.
Li (Z = 3): 1s22s1.
Na (Z = 11): 1s22s22p63s1.
K (Z = 19): 1s22s22p63s23p64s1.
Ca (Z = 20): 1s22s22p63s23p64s2.
Mg (Z = 12): 1s22s22p63s2.
C (Z = 6): 1s22s22p2.
Si(Z= 14): 1s22s22p63s23p2.
O (Z = 8): 1s22s22p4.
Số electron lớp ngoài cùng:
- Nguyên tử H, Li, Na, K đều có 1 electron ở lớp ngoài cùng.
- Nguyên tử Ca, Mg đều có 2 electron ở lớp ngoài cùng.
- Nguyên tử C, Si có 4 electron ở lớp ngoài cùng.
- Nguyên tử O có 6 electron ở lớp ngoài cùng.
6. Giải bài 6 trang 32 SGK Hóa 10 nâng cao
Cấu hình electron nguyên tử của các nguyên tố K(Z = 19); Ca (Z = 20) có đặc điểm gì?
Phương pháp giải
- Viết cấu hình electron → rút ra nhận xét
Hướng dẫn giải
- Cấu hình electron của K(Z = 19):1s22s22p63s23p64s1.
- Cấu hình electron cửa Ca(Z = 20): 1s22s22p63s23p64s2.
Nhận xét: Cấu hình e của nguyên tử 2 nguyên tố đó đều có 4 lớp e
Sự phân bố electron trên các obitan nguyên tử của các nguyên tố K(Z = 19) và Ca(Z = 20) có đặc điểm là đều bỏ qua phân lớp 3d, các electron thứ 19, 20 điền vào phân lớp 4s.
7. Giải bài 7 trang 32 SGK Hóa 10 nâng cao
Viết cấu hình electron của F (Z = 9), Cl (Z = 17) và cho biết khi nguyên tử của chúng nhận thêm 1 electron thì lớp electron ngoài cùng có đặc điểm gì?
Phương pháp giải
Viết cấu hình electron
- Bước 1: Xác định số electron của nguyên tử.
- Bước 2: Các electron được phân bố lần lượt vào các phân lớp theo chiều tăng của năng lượng trong nguyên tử (1s 2s 2p 3s 3p 4s 3d 4p 5s...) và tuân theo quy tắc sau:
+ Phân lớp s chứa tối đa 2 electron
+ Phân lớp p chứa tối đa 6 electron
+ Phân lớp d chứa tối đa 10 electron
+ Phân lớp f chứa tối đa 14 electron.
- Bước 3: Viết cấu hình electron biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
→ Nhận xét về đặc điểm electron ngoài cùng.
Hướng dẫn giải
Cấu hình electron của F(Z= 9): 1s22s22p5.
Cấu hình electron của Cl (Z = 17): 1s22s22p63s23p5
Khi nguyên tử nhận thêm 1 electron thì lớp ngoài cùng có 8 electron, giống nguyên tử khí hiếm.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 1: Thành phần nguyên tử
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 2: Hạt nhân nguyên tử, Nguyên tố hóa học
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 3: Đồng vị, Nguyên tử khối và nguyên tử khối trung bình
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 4: Sự chuyển động của electron trong nguyên tử, Obitan nguyên tử
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 5: Luyện tập
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 6: Lớp và phân lớp electron
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 8: Luyện tập Chương 1



