Giải bài tập SGK Hóa 10 Nâng cao Bài 19: Luyện tập
Dưới đây là Hướng dẫn giải Hóa 10 SGK nâng cao Chương 3 Bài 19 Luyện tập được eLib biên soạn và tổng hợp, nội dung bám sát theo chương trình SGK Hóa học 10 nâng cao giúp các em học sinh nắm vững phương pháp giải bài tập và ôn tập kiến thức hiệu quả hơn.
Mục lục nội dung

1. Giải bài 1 trang 82 SGK Hóa 10 nâng cao
Trình bày nội dung của quy tắc bát tử. Vận dụng quy tắc bát tử để giải thích sự hình thành liên kết ion trong các phân tử: LiF, KBr, CaCl2.
Phương pháp giải
- Theo quy tắc bát tử (8 electron) thì các nguyên tử của các nguyên tố có khuynh hướng liên kết với các nguyên tử khác để đạt được cấu hình bền vững của các khí hiếm với 8 electron (hoặc đối với heli) ở lớp ngoài cùng.
- Giải thích quá trình hình thành liên kết:
+ Viết cấu hình electron
+ Xác định trạng thái bền
Hướng dẫn giải
Theo quy tắc bát tử (8 electron) thì các nguyên tử của các nguyên tố có khuynh hướng liên kết với các nguyên tử khác để đạt được cấu hình bền vững của các khí hiếm với 8 electron (hoặc đối với heli) ở lớp ngoài cùng.
+ Các nguyên tử các nguyên tố s thường có khuynh hướng nhường electron lớp ngoài cùng để có lớp sát ngoài cùng 8 electron.
+ Các nguyên tử của các nguyên tố p là phi kim thường, có khuynh hướng thu thêm electron để cho lớp ngoài cùng của chúng có 8 electron.
Liên kết ion trong các phân tử:
+ LiF: Cấu hình electron: Li (Z = 3): 1s22s1
F (Z =9): 1s22s22p5
Nguyên tử Li có 1 electron lớp ngoài cùng nên nhường 1 e tạo ion dương Li+ . Nguyên tử F có 7 electron lớp ngoài cùng nên nhận thêm 1 electron của Li tạo ion F-, hình thành liên lết giữa Li+ và F-: LiF
+ KBr: Cấu hình electron: K ( Z= 11): 1s22s22p63s1
Br (Z= 35): 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5
Nguyên tử K có 1 electron lớp ngoài cùng nên nhường 1 electron tạo ion K + . Nguyên tử Br có 7 electron lớp ngoài cùng nên nhận thêm 1 electron của K tạo thành Br, thành liên kết giữa K+ và Br: KBr
+ CaCl2: cấu hình electron: Ca (Z = 20): 1s22s22p63s23p64s2
Cl (Z = 17): 1s22s22p63s23p5
Nguyên tử Ca có 2 electron lớp ngoài cùng nên 2 nguyên tử Cl nhường thêm 2 electron tạo ion dương Ca2+ , Nguyên tử có 7 electron lớp ngoài cùng nên 2 nguyên tử Cl nhận thêm 2 electron của 2 tạo thành ion Cl, hình thành liên kết giữa Ca2+ và Cl-: CaCl2.
2. Giải bài 2 trang 82 SGK Hóa 10 nâng cao
Sử dụng mô hình xen phủ các obitan nguyên tử để giải thích sự hình thành liên kết cộng hóa trị trong các phân tử: I2, HBr.
Phương pháp giải
- Liên kết hóa học trong I2 được hình thành nhờ sự xen phủ giữa obitan p chứa electron độc thân của mỗi nguyên tử iot.
- Liên kết hóa học trong phân tử HBr được hình thành nhờ sự xen obitan 1s của nguyên tử hiđro và obitan 4p có 1 electron độc nguyên tử brom.
Hướng dẫn giải
- Liên kết hóa học trong I2 được hình thành nhờ sự xen phủ giữa obitan p chứa electron độc thân của mỗi nguyên tử iot.
Sơ đồ:

- Liên kết hóa học trong phân tử HBr được hình thành nhờ sự xen obitan 1s của nguyên tử hiđro và obitan 4p có 1 electron độc nguyên tử brom.
Sơ đồ:

3. Giải bài 3 trang 82 SGK Hóa 10 nâng cao
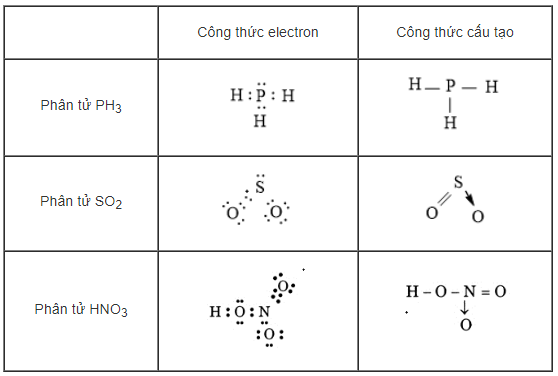
Hãy viết công thức electron và công thức cấu tạo của các phân tử sau: PH3, SO2, HNO3
Phương pháp giải
Viết cấu hình e của các nguyên tử tạo hợp chất
- Tính nhẩm số e mỗi nguyên tử góp chung = 8 – số e lớp ngoài cùng
- Biểu diễn các e lớp ngoài cùng và các cặp e chung (bằng các dấu chấm) lên xung quanh kí hiệu nguyên tử ⇒ công thức electron
- Thay mỗi cặp e chung bằng 1 gạch ngang ta được công thức cấu tạo
Hướng dẫn giải
4. Giải bài 4 trang 82 SGK Hóa 10 nâng cao
Dựa trên lí thuyết lai hóa các obitan nguyên tử, mô tả sự hình thành liên kết trong phân tử: BeCl2, BCl3. Biết phân tử BeCl2 có dạng đường thẳng, còn phân tử BCl3 có dạng tam giác đều.
Phương pháp giải
- Phân tử BeCl2 lai hóa sp
- Phân tử BCl3 lai hóa sp2
Hướng dẫn giải
- Phân tử BeCl2: Nguyên tử beri đã sử dụng 1 AOs và 1 AOp lai hóa với nhau để tạo thành hai obitan lai hóa sp nằm thẳng hàng với nhau về 2 phía đối xứng nhau. Beri đã sử dụng 2 obitan lai hóa sp xen phủ với 2 obitan p của 2 nguyên tử clo, tạo thành liên kết σ giữa Be – Cl
- Phân tử BCl3: Nguyên tử bo đã sử dụng 1 AOs và 2 AOp lai hóa với nhau để tạo thành 3 AO lai hóa sp2 nằm trong một mặt phẳng định hướng từ tâm đến 3 đỉnh của tam giác đều. Nguyên tử bo đã sử dụng 3 obitan lai hóa sp2 xen phủ với 3 obitan p của 3 nguyên tử clo tạo thành 3 liên kết σ giữa B – Cl.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 16: Khái niệm về liên kết hóa học, liên kết ion
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 17: Liên kết cộng hóa trị
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 18: Sự lai hóa các obitan nguyên tử
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 20: Tinh thể nguyên tử, tinh thể phân tử
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 21: Hiệu độ âm điện và liên kết hóa học
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 22: Hóa trị và số oxi hóa
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 23: Liên kết kim loại
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 24: Luyện tập Chương 3



