Giải bài tập SGK Hóa 10 Nâng cao Bài 21: Hiệu độ âm điện và liên kết hóa học
Để giúp các em học sinh học tập thật tốt bộ môn Hóa học 10, eLib xin giới thiệu nội dung giải bài tập SGK nâng cao bên dưới đây. Tài liệu gồm tất cả các bài tập có phương pháp và hướng dẫn giải chi tiết, rõ ràng, sẽ giúp các em ôn tập lại kiến thức, cũng cố kĩ năng làm bài hiệu quả. Mời các em cùng tham khảo.
Mục lục nội dung

1. Giải bài 1 trang 87 SGK Hóa 10 nâng cao
Chọn câu đúng trong các câu sau:
A. Trong liên kết cộng hóa trị, cặp electron chung lệch về phía nguyên tử có độ âm điện nhỏ hơn.
B. Liên kết cộng hóa trị có cực được tạo thành giữa hai nguyên tử có hiệu độ âm điện trong khoảng từ 0,4 đến nhỏ hơn 1,7.
C. Liên kết cộng hóa trị không cực được tạo nên từ các nguyên tử khác hẳn nhau về tính chất hóa học.
D. Hiệu độ âm điện giữa 2 nguyên tử lớn thì phân tử phân cực yếu.
Phương pháp giải
Để giải bài tập này các em cần nắm vững lý thuyết về liên kết cộng hóa trị, hiệu độ âm điện
Hướng dẫn giải
Liên kết cộng hóa trị có cực được tạo thành giữa hai nguyên tử có hiệu độ âm điện trong khoảng từ 0,4 đến nhỏ hơn 1,7.
Đáp án B
2. Giải bài 2 trang 87 SGK Hóa 10 nâng cao
Hãy cho biết thế nào là liên kết cộng hóa trị không cực? Cho ba ví dụ về liên kết cộng hóa trị không cực.
Phương pháp giải
Để giải bài tập này các em cần nắm vững lý thuyết về liên kết cộng hóa trị từ đó lấy được ví dụ chính xác
Hướng dẫn giải
- Liên kết cộng hóa trị không cực là liên kết trong đó cặp electron chung nằm ở giữa khoảng cách hai nguyên tử.
- Ví dụ: Liên kết trong phân tử F2, O2 và N2 là liên kết cộng hóa trị không cực.
3. Giải bài 3 trang 87 SGK Hóa 10 nâng cao
Hãy cho biết công thức electron của phân tử F2, phân tử HF, phân tử N2. Hãy cho biết, trong các phân tử đó thì phân tử nào có liên kết cộng hóa trị có cực và không cực.
Phương pháp giải
- Viết cấu hình e của các nguyên tử tạo hợp chất
- Tính nhẩm số e mỗi nguyên tử góp chung = 8 – số e lớp ngoài cùng
- Biểu diễn các e lớp ngoài cùng và các cặp e chung (bằng các dấu chấm) lên xung quanh kí hiệu nguyên tử ⇒ công thức electron
⇒ Phân loại được liên kết
Hướng dẫn giải
- Công thức electron phân tử:
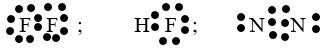
- Trong đó liên kết trong phân tử F2 và N2 là liên kết cộng hóa trị không cực. Còn liên kết trong phân tử HF là liên kết cộng hóa trị có cực.
4. Giải bài 4 trang 87 SGK Hóa 10 nâng cao
Xét các phân tử sau đây: NaCl, MgCl2, AlCl3, HCl. Hãy cho biết liên kết trong phân tử nào là liên kết cộng hóa trị và liên kết trong phân tử nào là liên kết ion.
Phương pháp giải
Kí hiệu: Δx là hiệu độ âm điện của 2 nguyên tố, Δx ≥ 0.
- Liên kết cộng hóa trị không cực 0 ≤ Δx < 0,4
- Liên kết cộng hóa trị có cực: 0,4 ≤ Δx < 1,7
- Liên kết ion: Δx ≥ 1,7.
Hướng dẫn giải
- Liên kết phân tử NaCl, MgCl2 là liên kết ion.
- Liên kết trong phân tử AlCl3 và HCl là liên kết cộng hóa trị có cực
5. Giải bài 5 trang 87 SGK Hóa 10 nâng cao
Xét phân tử sau đây HBr, O2, H2, NH3. Hãy cho biết liên kết trong phân tử nào có cực, liên kết phân tử nào không cực.
Phương pháp giải
Kí hiệu: Δx là hiệu độ âm điện của 2 nguyên tố, Δx ≥ 0.
- Liên kết cộng hóa trị không cực 0 ≤ Δx < 0,4
- Liên kết cộng hóa trị có cực: 0,4 ≤ Δx < 1,7
- Liên kết ion: Δx ≥ 1,7.
Hướng dẫn giải
- Liên kết trong phân tử HBr, NH3 là liên kết cộng hóa trị có cực.
- Liên kết trong phân tử O2, H2 là liên kết cộng hóa trị không cực.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 16: Khái niệm về liên kết hóa học, liên kết ion
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 17: Liên kết cộng hóa trị
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 18: Sự lai hóa các obitan nguyên tử
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 19: Luyện tập
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 20: Tinh thể nguyên tử, tinh thể phân tử
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 22: Hóa trị và số oxi hóa
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 23: Liên kết kim loại
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 24: Luyện tập Chương 3



