Giải bài tập SGK Hóa 10 Nâng cao Bài 24: Luyện tập Chương 3
Mời các em học sinh cùng tham khảo nội dung giải bài 24 SGK Hóa học 10 nâng cao dưới đây. Tài liệu được biên soạn và tổng hợp với nội dung đầy đủ, chi tiết, hy vọng đây sẽ là tài liệu hữu ích giúp các em học tập thật tốt.
Mục lục nội dung
1. Giải bài 1 trang 95 SGK Hóa học 10 nâng cao
2. Giải bài 2 trang 95 SGK Hóa học 10 nâng cao
3. Giải bài 3 trang 95 SGK Hóa học 10 nâng cao
4. Giải bài 4 trang 95 SGK Hóa học 10 nâng cao
5. Giải bài 5 trang 96 SGK Hóa học 10 nâng cao
6. Giải bài 6 trang 96 SGK Hóa học 10 nâng cao
7. Giải bài 7 trang 96 SGK Hóa học 10 nâng cao

1. Giải bài 1 trang 95 SGK Hóa 10 nâng cao
Viết phương trình biểu diễn sự hình thành các tương ứng:
a) Na → Na+
b) Mg → Mg2+
c) Al → Al3+
d) Cl → Cl-
e) S → S2-
f) O → O2-
Phương pháp giải
Hướng dẫn giải
a) Na → Na+ + 1e.
b) Mg → Mg2+ +2e.
c) Al → Al3+ + 3e.
d) Cl + 1e → Cl-.
e) S + 2e → S2-.
f) O + 2e → O2-
2. Giải bài 2 trang 95 SGK Hóa 10 nâng cao
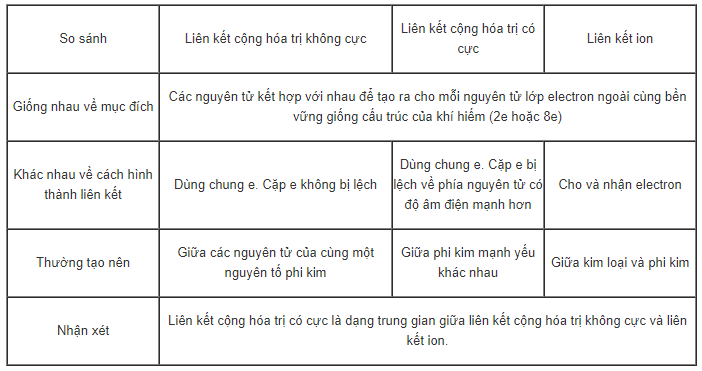
Trình bày sự giống nhau và khác nhau giữa 3 loại liên kết sau:
a) Liên kết ion.
b) Liên kết cộng hóa trị không cực.
c) Liên kết cộng hóa trị có cực.
Phương pháp giải
Hướng dẫn giải
3. Giải bài 3 trang 95 SGK Hóa 10 nâng cao
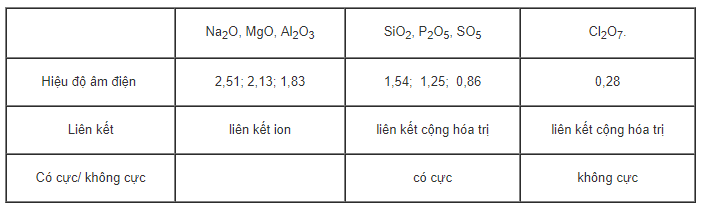
Cho dãy oxit sau: Na2P, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
Dựa vào giá trị hiệu độ âm điện của hai nguyên tử trong phân tử, hãy xác định kiểu liên kết trong từng phân tử oxit (dựa vào số liệu ở bảng 2.3 SGK Hóa học lớp 10).
Phương pháp giải
- Kí hiệu: Δx là hiệu độ âm điện của 2 nguyên tố, Δx ≥ 0.
- Liên kết cộng hóa trị không cực: 0 ≤ Δx < 0,4
- Liên kết cộng hóa trị có cực: 0,4 ≤ Δx < 1,7
- Liên kết ion: Δx ≥ 1,7.
Hướng dẫn giải
4. Giải bài 4 trang 96 SGK Hóa 10 nâng cao
a) Dựa vào độ âm điện, hãy xét xem tính phi kim thay đổi như thế nào trong dãy nguyên tố sau: O, Cl, S, H.
b) Viết công thức cấu tạo của các phân tử sau: Cl2O, NCl3, H2S, NH3. Xem xét phân tử nào có liên kết phân cực mạnh nhất.
Phương pháp giải
- Kí hiệu: Δx là hiệu độ âm điện của 2 nguyên tố, Δx ≥ 0.
- Liên kết cộng hóa trị không cực: 0 ≤ Δx < 0,4
- Liên kết cộng hóa trị có cực: 0,4 ≤ Δx < 1,7
- Liên kết ion: Δx ≥ 1,7.
Hướng dẫn giải
Câu a: Độ âm điện của O; Cl; S; H lần lượt là: 3,44; 3,16; 2,58; 2,2.
Nhận xét: Tính phi kim giảm dần (O > Cl > S > H).
Câu b:
Công thức cấu tạo:
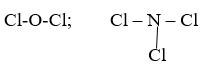
Cl2O NCl3
Hiệu độ âm điện: 0,28 0,12

H2S NH3
Hiệu độ âm điện: 0,38 0,84
Phân tử Cl2O, NCl3, H2S. Có liên kết cộng hóa trị không phân cực. Phân tử NH3 có liên kết cộng hóa trị phân cực mạnh nhất.
5. Giải bài 5 trang 96 SGK Hóa 10 nâng cao
Nguyên tử của một nguyên tố có cấu hình electron 1s22s22p3
a) Xác định vị trí của nguyên tố đó trong bảng tuần hoàn, suy ra công thức của hợp chất đơn giản nhất của hiđro.
b) Viết công thức electron và công thức cấu tạo phân tử đơn chất của nguyên tố đó.
Phương pháp giải
- Từ cấu hình electron → vị trí trong bảng tuần hoàn
- Nắm vững các bước viết CTCT và CT electron của chất
+ Tính nhẩm số e mỗi nguyên tử góp chung = 8 – số e lớp ngoài cùng
+ Biểu diễn các e lớp ngoài cùng và các cặp e chung (bằng các dấu chấm) lên xung quanh kí hiệu nguyên tử ⇒ công thức electron
+ Thay mỗi cặp e chung bằng 1 gạch ngang ta được công thức cấu tạo
Hướng dẫn giải
Câu a: Vị trí của nguyên tố trong bảng tuần hoàn:
- Tổng số electron là 7, suy ra nguyên tố ở ô thứ 7 trong bảng tuần hoàn.
- Có 2 lớp electron, suy ra nguyên tố thuộc chu kì 2.
- Thuộc nhóm VA vì có 5 electron ở lớp ngoài cùng, đó là nitơ (N).
- Công thức phân tử của hợp chất khí với hiđro là NH3.
Câu b:
Công thức electron:
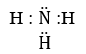
Công thức cấu tạo:
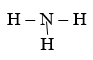
6. Giải bài 6 trang 96 SGK Hóa 10 nâng cao
Có bao nhiêu electron trong mỗi ion sau đây: NO2-, SO22- , CO22- ; Br-, NH4+
Phương pháp giải
Xác định số electron trong mỗi nguyên tử N (e = 7), H (e = 1), O (e = 8), S (e = 16), C( e = 6), Br(e = 35)
Hướng dẫn giải
Trong NO3- :7 + 3.8 + 1 = 32 electron do NO3- đã nhận thêm 1e
Trong SO42- :16 + 4.8 + 2 = 50 electron;
Trong Br- : 35 + 1 = 36 electron;
Trong CO32- : 6 + 3.8 + 2 = 32 electron;
Trong NH4+: 7 + 4.1 – 1 = 10 electron do NH4+ đã nhường đi 1 e
7. Giải bài 7 trang 96 SGK Hóa 10 nâng cao
Tổng số proton trong hai ion XA32- và XA42- lần lượt là 40 và 48. Xác định các nguyên tố X, A và các ion XA32- , XA42-
Phương pháp giải
Ta có: ZX + 3ZA = 40 và ZX + 4ZA = 48
→ ZA, ZX = ?
Hướng dẫn giải
Trong nguyên tử A có số p = số e = ZA; trong nguyên tử B có số p = số e = ZA
Theo đề bài ta có:
ZX + 3ZA = 40 và ZX + 4ZA = 48
⇒ ZA = 8 và ZX = 16
Vậy nguyên tố X là S và nguyên tố A là O. Các ion đã cho là SO32- và SO42-
8. Giải bài 8 trang 96 SGK Hóa 10 nâng cao
Xác định điện hóa trị của các nguyên tử và nhóm nguyên tử trong những hợp chất ion sau: BaO, K2O, CaCl2, AlF3, Ca(NO3)2.
Phương pháp giải
Nắm được khái niệm điện hóa trị:
Trong hợp chất ion, hóa trị của một nguyên tố bằng điện tích của ion và được gọi là điện hóa trị của nguyên tố đó.
(Chú ý: Điện hóa trị viết số trước dấu sau)
Hướng dẫn giải
Điện hóa trị của các nguyên tử và nhóm nguyên tử là:
Ba = 2+ ; O = 2-; K= 1+; Ca = 2+; Cl = 1-; Al = 3+; F= 1-; NO3 = 1-
9. Giải bài 9 trang 96 SGK Hóa 10 nâng cao
Xác định cộng hóa trị của nguyên tử những nguyên tố trong những hợp chât cộng hóa trị sau: NH3, HBr, AlBr3, PH3, CO2
Phương pháp giải
Hóa trị của một nguyên tố trong hợp chất cộng hóa trị gọi là cộng hóa trị và bằng số liên kết cộng hóa trị mà nguyên tử của nguyên tố đó tạo ra được với các nguyên tử khác trong phân tử.
Hướng dẫn giải
Cộng hóa trị của các nguyên tố là:
NH3: N có cộng hóa trị là 3 và H có cộng hóa trị là 1
HBr: H có cộng hóa trị là 1 và Br có cộng hóa trị là 1
AlBr3: Al có cộng hóa trị là 3 và Br có cộng hóa trị là 1
PH3: P có cộng hóa trị là 3 và H có cộng hóa trị là 1
CO2: C có cộng hóa trị là 4 và O có cộng hóa trị là 2.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 16: Khái niệm về liên kết hóa học, liên kết ion
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 17: Liên kết cộng hóa trị
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 18: Sự lai hóa các obitan nguyên tử
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 19: Luyện tập
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 20: Tinh thể nguyên tử, tinh thể phân tử
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 21: Hiệu độ âm điện và liên kết hóa học
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 22: Hóa trị và số oxi hóa
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 23: Liên kết kim loại



