Giải bài tập SGK Hóa 10 Nâng cao Bài 17: Liên kết cộng hóa trị
eLib xin giới thiệu đến quý thầy cô giáo và các em học sinh nội dung giải bài tập Liên kết cộng hóa trị SGK Hóa học 10 nâng cao dưới đây. Tài liệu gồm các bài tập có phương pháp và hướng dẫn giải chi tiết sẽ giúp các em ôn tập thật tốt kiến thức, cũng cố kỹ năng làm bài tập hiệu quả. Mời các em cùng tham khảo.
Mục lục nội dung

1. Giải bài 1 trang 75 SGK Hóa 10 nâng cao
Chọn định nghĩa đúng nhất về liên kết cộng hóa trị.
Liên kết cộng hóa trị là liên kết:
A. Giữa các phi kim với nhau.
B. Trong đó cặp electron chung bị lệch về một nguyên tử.
C. Được hình thành do sự dùng chung electron của 2 nguyên tử khác nhau.
D. Được hình thành giữa 2 nguyên tử bằng một hay nhiều cặp electron chung.
Phương pháp giải
Để giải bài tập này cần nắm vững khái niệm liên kết cộng hóa trị
Hướng dẫn giải
Liên kết cộng hóa trị là liên kết được hình thành giữa 2 nguyên tử bằng một hay nhiều cặp electron chung.
Đáp án D
2. Giải bài 2 trang 75 SGK Hóa 10 nâng cao
Hãy giải thích sự hình thành cặp electron liên kết giữa nguyên tử C và các nguyên tử H trong phân tử CH4, giữa nguyên tử O và các nguyên tử H trong phân tử H2O, giữa nguyên tử S và các nguyên tử H trong phân tử H2S.
Phương pháp giải
Nắm vững khả năng liên kết giữa các chất để giải thích sự hình thành cặp electron
Hướng dẫn giải
- Trong phân tử CH4, nguyên tử cacbon bỏ ra 4 electron lớp ngoài cùng tạo thành 4 cặp electron chung với 4 nguyên tử hiđro. Mỗi nguyên tử trong phân tử CH4 đều đạt được cấu hình bền của nguyên tử khí hiếm gần nhất: Mỗi nguyên tử hiđro có 2 electron (giống He), còn nguyên tử cacbon có 8 electron lớp ngoài cùng (giống Ne).
- Trong phân tử H2O, nguyên tử oxi bỏ ra 2 electron lớp ngoài cùng tạo thành 2 cặp electron chung với 2 nguyên tử hiđro. Mỗi nguyên tử trong phân tử H2O đều đạt được cấu hình bền của nguyên tử khí hiếm gần nhất: Mỗi nguyên tử hiđro có 2 electron (giống He), còn nguyên tử oxi có 8 electron lớp ngoài cùng (giống Ne).
- Trong phân tử H2S, nguyên tử lưu huỳnh bỏ ra 2 electron lớp ngoài cùng tạo thành 2 cặp electron chung với 2 nguyên tử hiđro. Mỗi nguyên tử trong phân tử H2S đều đạt được cấu hình bền của nguyên tử khí hiếm gần nhât: Mỗi nguyên tử hiđro có 2 electron (giống He), còn nguyên tử lưu huỳnh có 8 electron lớp ngoài cùng.
3. Giải bài 3 trang 75 SGK Hóa 10 nâng cao
Giải thích sự hình thành cặp electron liên kết giữa hai nguyên tử N trong phân tử N2, giữa nguyên tử H và nguyên tử Cl trong phân tử HCl.
Phương pháp giải
Sự hình thành các cặp electron dùng chung
Hướng dẫn giải
- Trong phân tử N2, mỗi nguyên tử nitơ bỏ ra 3 electron lớp ngoài cùng tạo thành 3 cặp electron chung giữa hai nguyên tử nitơ. Mỗi nguyên tử trong phân tử N2 đều đạt được cấu hình bền của nguyên tử khí hiếm gần nhất: Mỗi nguyên tử nitơ có 8 electron lớp ngoài cùng.
- Trong phân tử HCl, nguyên tử clo bỏ ra 1 electron lớp ngoài dùng tạo thành 1 cặp electron chung với một nguyên tử hiđro. Mỗi nguyên tử trong phân tử HCl đều đạt được cấu hình bền của nguyên tử khí hiếm gần nhất: nguyên tử hiđro có 2 electron, còn nguyên tử clo có 8 electron lớp ngoài cùng.
4. Giải bài 4 trang 75 SGK Hóa 10 nâng cao
Giải thích sự hình thành liên kết cộng hóa trị bằng sự xen phủ các obitan trong phân tử HCl.
Phương pháp giải
Liên kết hóa học trong phân tử hợp chất HCl được hình thành nhờ sự xen phủ giữa obitan 1s của nguyên tử hiđro và obitan 3p có 1 electron độc thân của nguyên tử clo.
Hướng dẫn giải
Liên kết hóa học trong phân tử hợp chất HCl được hình thành nhờ sự xen phủ giữa obitan 1s của nguyên tử hiđro và obitan 3p có 1 electron độc thân của nguyên tử clo.
Sơ đồ xen phủ obitan trong phân tử HCl là:

5. Giải bài 5 trang 75 SGK Hóa 10 nâng cao
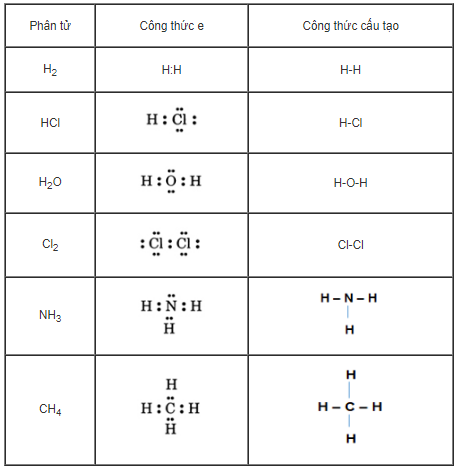
Hãy viết công thức electron và công thức cấu tạo của các phân tử sau đây: H2, HCl, H2O, Cl2, NH3, CH4.
Phương pháp giải
Viết cấu hình electron, biểu diễn công thức e bằng 1 hoặc 1 cặp electron dùng chung
Hướng dẫn giải
6. Giải bài 6 trang 75 SGK Hóa 10 nâng cao
X, Y, Z là những nguyên tố có số đơn vị điện tích hạt nhân là 9, 19, 8.
a) Viết cấu hình electron nguyên tử của các nguyên tố đó.
b) Dự đoán kiểu liên kết hóa học có thể có giữa các cặp X và Y, Y và Z, X và Z.
Phương pháp giải
Dựa vào điện tích hạt nhân → cấu hình electron, từ đó xác định loại liên kết
Hướng dẫn giải
Câu a: Cấu hình electron nguyên tử là:
X (Z = 9): 1s22s22p5
Y (Z = 19): 1s22s22p63s23p64s1
Z (Z = 8): 1s22s22p4
Câu b: Liên kết giữa X và Y là liên kết ion
Liên kết giữa X và Z là liên kết cộng hóa trị có cực
Liên kết giữa Y và Z là liên kết ion.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 16: Khái niệm về liên kết hóa học, liên kết ion
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 18: Sự lai hóa các obitan nguyên tử
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 19: Luyện tập
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 20: Tinh thể nguyên tử, tinh thể phân tử
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 21: Hiệu độ âm điện và liên kết hóa học
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 22: Hóa trị và số oxi hóa
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 23: Liên kết kim loại
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 24: Luyện tập Chương 3



