Giải bài tập SGK Hóa 10 Nâng cao Bài 43: Lưu huỳnh
Dưới đây là Hướng dẫn giải Hóa 10 SGK nâng cao Chương 6 Bài 43 Lưu huỳnh được eLib biên soạn và tổng hợp, nội dung bám sát theo chương trình SGK Hóa học 10 nâng cao giúp các em học sinh nắm vững phương pháp giải bài tập và ôn tập kiến thức hiệu quả hơn.
Mục lục nội dung

1. Bài 1 trang 172 SGK Hóa 10 nâng cao
Cấu hình electron nguyên tử nào là của lưu huỳnh ở trạng thái kích thích?
A. 1s22s22p63s23p4
B. 1s22s22p4
C. 1s22s22p63s23p33d1
D. 1s22s22p63s23p6
Hãy chọn câu trả lời đúng.
Phương pháp giải
Ở trạng thái kích thích nguyên tử lưu huỳnh có thể có 4,6 electron độc thân
Hướng dẫn giải
Cấu hình electron nguyên tử S ở trạng thái kích thích 1s22s22p63s23p33d1
Chọn C.
2. Bài 2 trang 172 SGK Hóa 10 nâng cao
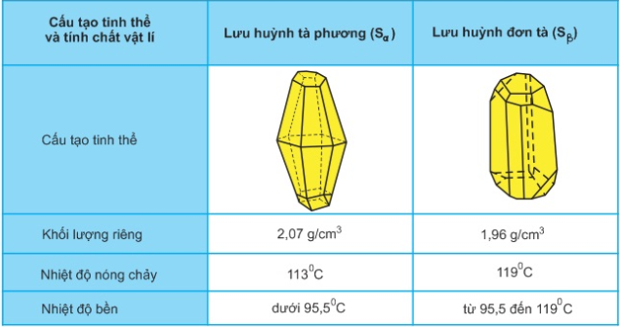
Ta có thể dự đoán sự thay đổi về khối lượng riêng, về thể tích diễn ra như thế nào khi giữ lưu huỳnh đơn tà (Sβ) vài ngày ở nhiệt độ phòng?
Phương pháp giải
- Chúng biến đổi qua lại với nhau theo nhiệt độ.
Hướng dẫn giải
- Ở nhiệt độ phòng, có sự chuyển hóa từ Sβ → Sα vì vậy khi giữ Sβ vài ngày ở nhiệt độ phòng thì:
+ Khối lượng riêng của lưu huỳnh tăng dần.
+ Thể tích của lưu huỳnh giảm.
3. Bài 3 trang 172 SGK Hóa 10 nâng cao
Hãy viết các phương trình hóa học biểu diễn sự biến đổi số oxi hóa của nguyến tố lưu huỳnh theo sơ đồ sau:
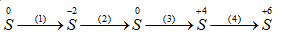
Phương pháp giải
Dựa vào tính chất hóa học của S để viết phương trình hóa học minh họa
Hướng dẫn giải
\(\begin{array}{l}
(1)\,\,\,\mathop S\limits^0 + {H_2} \to {H_2}\mathop S\limits^{ - 2} \\
(2)\,\,\,2{H_2}\mathop S\limits^{ - 2} + {O_2} \to 2\mathop S\limits^0 + 2{H_2}O\\
(3)\,\,\,\,\mathop S\limits^0 + O \to \mathop S\limits^{ + 4} {O_2}\\
(4)\,\,\,\,\mathop S\limits^{ + 4} {O_2} + B{r_2} + 2{H_2}O \to 2HBr + {H_2}\mathop S\limits^{ + 6} {O_4}
\end{array}\)
4. Bài 4 trang 172 SGK Hóa 10 nâng cao
Đun nóng một hỗn hợp bột gồm 2,97g Al và 4,08g S trong môi trường kín không có không khí, được sản phẩm là hỗn hợp rắn A. Ngâm A trong dung dịch HCl dư, thu được hỗn hợp khí B.
a) Hãy viết phương trình hóa học của các phản ứng.
b) Xác định thành phần định tính và khối lượng các chất trong hỗn hợp A.
c) Xác định thành phần định tính và thể tích các chất trong hỗn hợp khí B ở điều kiện tiêu chuẩn.
Phương pháp giải
- Viết PTHH của phản ứng
- Tính nAl, nS
→ mAl, mAl2S2
Từ phương trình → nH2, nH2S → V = ?
Hướng dẫn giải
Câu a: Số mol Al: 2,97/27 = 0,11 mol; số mol S: 4,08/32 = 0,1275 mol
2Al + 3S → Al2S3 (1)
Trước phản ứng: 0,11 0,1275 0
Phản ứng: 0,085 0,1275 0,0425
Sau phản ứng: 0,025 0 0,0425
2Al dư + 6HCl → 2AlCl3 + 3H2 (2)
0,025 0,0375
Al2S3 + 6HCl → 2AlCl3 + 3H2S (3)
0,0425 0,1275
Câu b: Hỗn hợp rắn A: Al2S3 0,0425 mol; Aldư 0,025 mol
mAl dư = 0,025.27 = 0,675 (gam); mAl2S2 = 0,0425.150 = 6,375 (gam)
Câu c:
Từ (2) ⇒ nH2= 0,0375 (mol) ⇒ VH2 = 0,0375.22,4 = 0,84 (lít)
Từ (3) ⇒ nH2S = 0,1275 (mol) ⇒ VH2S = 0,1275.22,4=2,856 (lít)
Tham khảo thêm
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 40: Khái quát về nhóm oxi
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 41: Oxi
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 42: Ozon và hiđro peoxit
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 44: Hiđro sunfua
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 45: Hợp chất có oxi của lưu huỳnh
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 46: Luyện tập chương 6



