Giải bài tập SGK Hóa 12 Bài 33: Hợp kim và sắt
Nội dung hướng dẫn Giải bài tập Hóa 12 Bài 33 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về hợp kim của sắt. Mời các em cùng theo dõi.
Mục lục nội dung

1. Giải bài 1 trang 151 SGK Hóa học 12
Nêu những phản ứng chính xảy ra trong lò cao.
Phương pháp giải
Để trả lời câu hỏi trên cần nắm rõ lý thuyết về phản ứng chính xảy ra trong lò cao.
Hướng dẫn giải
Những phản ứng chính xảy ra trong lò cao:
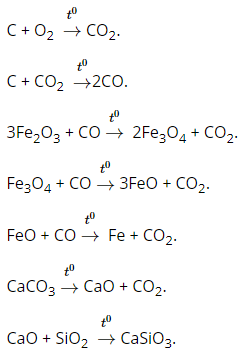
2. Giải bài 2 trang 151 SGK Hóa học 12
Nêu các phương pháp luyện thép và cho biết ưu điểm, nhược điểm của mỗi phương pháp.
Phương pháp giải
Để trả lời câu hỏi trên cần nắm rõ các phương pháp luyện thép.
Hướng dẫn giải
- Phương pháp lò thổi oxy
- O2 tinh khiết nén dưới áp suất 10 atm được thổi đều trên bề mặt và trong lòng gang nóng chảy, do vậy oxi đã oxi hóa rất mạnh các tạp chất (Si, C,P,S,...)
- Ngày nay 80% thép được sản suất theo phương pháp này.
- Ưu điểm :Phản ứng trong lò gang tỏa nhiều nhiệt, nâng cao chất lượng thép, thời gian ngắn, sản suất được nhiều thép
- Nhược điểm: không sản suất được thép chất lượng cao
- Phương pháp Mac-tanh(lò bằng)
- Nhiên liệu là khí đốt hoặc dầu cùng với không khí và oxi được phun vào lò để oxy hóa tạp chất trong gang
- Ưu điểm: Có thể bổ sung các nguyên tố trong thép và bổ sung các nguyên tố cần thiết để sản xuất ra thép chất lượng cao
- Nhược điểm:Tốn nhiên liệu để đốt lò , từ 5 giờ đến 8 giờ.
- Phương pháp lò điện
Nhiệt lượng sinh ra trong lò hồ quang điện giữa các điện cực bằng than chì và gang lỏng tỏa ra nhiệt độ 3000 độ C và dễ điều chỉnh hơn các lò trên.
- Ưu điểm là luyện được thép có các thành phần khó nóng chảy như vonfram, molipden, crom,... và không chứa những tạp chất có hại như lưu huỳnh, photpho.
- Nhược điểm là dung tích không lớn, điện năng tiêu thụ cao.
3. Giải bài 3 trang 151 SGK Hóa học 12
Một loại quặng chứa sắt trong tự nhiên đã được loại bỏ tạp chất. Hòa tan quặng này trong dung dịch HNO3 thấy có khí màu nâu bay ra, dung dịch thu được cho tác dụng với BaCl2 có thấy kết tủa màu trắng (không tan trong axit mạnh). Loại quặng đó là
A. xiđêrit
B. hematit.
C. manhetit.
D. pirit sắt.
Phương pháp giải
Ghi nhớ công thức các quặng sắt:
A. xiđêrit : FeCO3, B. hemantit: Fe2O3, C. manhetit: Fe3O4, D. pirit sắt: FeS2
Dựa vào thành phần của các nguyên tố có trong chất này so với hiện tượng bài toán => chọn đáp án phù hợp.
Hướng dẫn giải
Hòa tan quặng đó trong dung dịch HNO3, dung dịch thu được cho tác dụng với dung dịch BaCl2 thấy có kết tủa trắng (không tan trong axit mạnh)
→ Kết tủa trắng là BaSO4 → Tương ứng muối Fe2(SO4)3
⇒ Quặng phải chứa nguyên tố lưu huỳnh (S) ⇒ Quặng sắt ban đầu có công thức là FeS2 (pirit sắt).
Đáp án đúng là D.
4. Giải bài 4 trang 151 SGK Hóa học 12
Để khử hoàn toàn 17,6 gam hỗn hợp gồm Fe, FeO, Fe3O4, Fe2O3 đến Fe cần vừa đủ 2,24 lít khí CO (đktc). Khối lượng sắt thu được là
A. 15 gam.
B. 16 gam.
C. 17 gam.
D. 18 gam.
Phương pháp giải
FexOy + yCO → xFe + yCO2
nCO2 = nCO
Áp dụng định luật bảo toàn khối lượng ta có:
mOXIT + mCO = mKL + mCO2
=> mKL = ?
Hướng dẫn giải
Áp dụng định luật bảo toàn khối lượng ta có:
mhh + mCO = mFe + mCO2
⇒ mFe = 17,6 + 0,1.28 - 0,1.44 = 16 (gam)
Khối lượng sắt thu được là 16 gam.
5. Giải bài 5 trang 151 SGK Hóa học 12
Nung một mẫu thép thường có khối lượng 10 gam trong O2 dư thu được 0,1568 lít khí CO2 (đktc). Thành phần phần trăm theo khối lượng của cacbon trong mẫu thép đó là
A. 0,82%.
B. 0,84%
C. 0,85%.
D. 0,86%.
Phương pháp giải
Để tính thành phần phần trăm theo khối lượng của cacbon ta cần ghi nhớ thép là hợp kim của Fe với C (hàm lượng C từ 0,01 - 2%)
Viết PTHH, tính toán theo PTHH
C + O2 \(\xrightarrow{{{t^o}}}\) CO2
Hướng dẫn giải
\({n_C} = {n_{C{O_2}}} = \frac{{0,1568}}{{22,4}} = 0,007\,mol\)
⇒ mC = 0,007.12 = 0,084 (gam)
⇒ \(\% {m_C} = \frac{{0,084}}{{10}}.100 = 0,84\% \)
Thành phần phần trăm theo khối lượng của cacbon trong mẫu thép đó là 0,84%
6. Giải bài 6 trang 151 SGK Hóa học 12
Cần bao nhiêu tấn quặng manhetit chứa 80% Fe3O4 để có thể sản xuất được 800 tấn gang có hàm lượng sắt là 95%. Biết rằng trong quá trình sản xuất, lượng sắt bị hao hụt là 1%.
Phương pháp giải
Để tính khối lượng quặng manhetit, ta thực hiện các bước:
- Bước 1: Tính khối lượng sắt có trong gang.
- Bước 2: Tính khối lượng sắt thực tế
- Bước 3: Tính khối lượng quặng manhetit cần dùng.
Hướng dẫn giải
Khối lượng sắt có trong 800 tấn gang chứa 95% sắt là: \(\frac{{800.95}}{{100}} = 760\) (tấn)
Khối lượng sắt thực tế cần phải có là: \(\frac{{760.100}}{{99}} = 767,68\) (tấn)
Fe3O4 → 3Fe
232 tấn 3.56 = 168 tấn
Muốn có 767,68 tấn sắt, cần: \(\frac{{767,68.232}}{{168}} = 1060,13\) (tấn) Fe3O4
Khối lượng quặng manhetit cần dùng là: \(\frac{{1060,13.100}}{{80}} = 1325,163\) (tấn)
Vậy cần 1325,163 tấn quặng manhetit để sản xuất 800 tấn gang.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 12 Bài 31: Sắt
- doc Giải bài tập SGK Hóa 12 Bài 32: Hợp chất của sắt
- doc Giải bài tập SGK Hóa 12 Bài 34: Crom và hợp chất của crom
- doc Giải bài tập SGK Hóa 12 Bài 35: Đồng và hợp chất của đồng
- doc Giải bài tập SGK Hóa 12 Bài 36: Sơ lược về niken, kẽm, chì, thiếc
- doc Giải bài tập SGK Hóa 12 Bài 37: Luyện tập: Tính chất hóa học của sắt và hợp chất của sắt
- doc Giải bài tập SGK Hóa 12 Bài 38: Luyện tập: TCHH của crom, đồng và hợp chất của chúng



