Hoá học 8 Bài 16: Phương trình hóa học
Nội dung bài học Phương trình hoá học tìm hiểu về khái niệm, các bước lập phương trình hoá học; Ý nghĩa của phương trình hoá học: Cho biết các chất phản ứng và sản phẩm, tỉ lệ số phân tử, số nguyên tử giữa các chất trong phản ứng.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Lập phương trình hóa học
a. Phương trình hóa học
Phương trình chữ của phản ứng: Hiđrô + Ôxi → Nước
Sơ đồ phản ứng: H2 + O2 → H2O
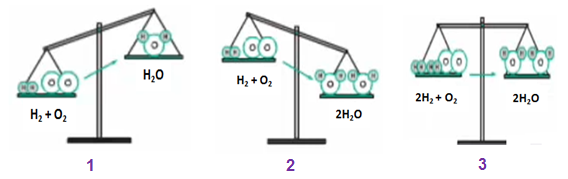
- Ở hình 1: Nếu theo sơ đồ phản ứng H2 + O2 → H2O thì
+ Vế trái: 2 nguyên tử H và 2 nguyên tử O
+ Vế phải: 2 nguyên tử H và 1 nguyên tử O
⇒ Vế trái sẽ có khối lượng nhiều hơn vì hơn 1 nguyên tử O
- Ở hình 2: Vậy nếu vế trái nhiều hơn 1 nguyên tử O thì ta thêm hệ số 2 trước vế phải. Lúc này:
+ Vế trái: 2 nguyên tử H và 2 nguyên tử O
+ Vế phải: 4 nguyên tử H và 2 nguyên tử O
⇒ Vế phải có khối lượng nhiều hơn, do hơn 2 nguyên tử H
- Ở hình 3: Ta thêm hệ số 2 vào trước H2 và H2O
+ Vế trái: 4 nguyên tử H và 2 nguyên tử O
+ Vế phải: 4 nguyên tử H và 2 nguyên tử O
⇒ Khối lượng của hai vế bằng nhau
Kết luận:
Phương trình hóa học: 2H2 + O2 → 2H2O
Phương trình hóa học dùng để biểu diễn ngắn gọn phản ứng hoá học. Gồm công thức hóa học và hệ số thích hợp của những chất tham gia và chất tạo thành.
b. Cách bước lập phương trình hóa học
- Các bước lập phương trình hóa học
Bước 1: Viết sơ đồ phản ứng gồm công thức hóa học của các chất phản ứng và sản phẩm.
Bước 2: Cân bằng số nguyên tử của các nguyên tố có trong phản ứng: Tìm hệ số thích hợp đặt trước các công thức.
Bước 3: Viết phương trình hóa học.
1.2. Ý nghĩa của phương trình hóa học
- Phương trình hóa học cho biết: Tỉ lệ về số nguyên tử, số phân tử giữa các chất trong phản ứng. Tỉ lệ này đúng bằng tỉ lệ hệ số mỗi chất trong phương trình.
- Ví dụ: Phương trình phản ứng 4Al + 3O2 2Al2O3
+ Tỉ lệ số nguyên tử Al : Số phân tử O2 : Số phân tử Al2O3 = 4 : 3 : 2
+ Điều này được hiểu là: Cứ 4 nguyên tử Al tác dụng với 3 phân tử O2 tạo thành 2 phân tử Al2O3
2. Bài tập minh họa
2.1. Dạng 1: Cân bằng phương trình hoá học bằng phương pháp chẵn - lẻ
Bài 1: Cân bằng PTHH P + O2 → P2O5
Hướng dẫn giải
- Để ý nguyển tử Oxi ở VP là 5 trong P2O5 nên ta thêm hệ số 2 trước P2O5để số nguyên tử của Oxi là chẵn.
Khi đó, VT có 2 nguyên tử Oxi trong O2 nên ta phải thêm hệ số 5 vào trước O2.
P + 5O2 → 2P2O5
- Bây giờ ở VP có 4 nguyên tử P (phốt pho) trong 2 P2O5, trong khi VT có 1 nguyên tử P nên ta đặt hệ số 4 trước nguyên tử P.
4P + 5O2 → 2P2O5
⇒ Phương trình phản ứng hoàn thành, số nguyên tử mỗi nguyên tố VT = VP
Bài 2: Lập phương trình hóa học cho phản ứng giữa Natri cacbonat và Canxi hidroxit tạo thành sản phẩm là Canxi cacbonat và Natri hidroxit.
Hướng dẫn giải
Phương trình chữ của phản ứng là: Natri cacbonat + Canxi hidroxit → Canxi cacbonat + Natri hidroxit
Sơ đồ phản ứng: Na2CO3 + Ca(OH)2 → CaCO3 + NaOH
Nhận xét:
Vế trái: có 2 nguyên tử Na và 1 nhóm CO3 + 1 nguyên tử Ca và 2 nhóm OH
Vế phải: có 1 nguyên tử Na và 1 nhóm CO3 + 1 nguyên tử Ca và 1 nhóm OH
Như vậy: Ta thêm hệ số 2 trước Natri hidroxit thì sẽ cân bằng khối lượng của vế phải và vế trái
Phương trình hóa học: Na2CO3 + Ca(OH)2 → CaCO3 + 2NaOH
2.2. Dạng 2: Cân bằng phương trình hoá học bằng phương pháp
Cân bằng PTHH Cu + H2SO4 → CuSO4 + SO2 + H2O
Hướng dẫn giải
Bước 1: Đưa các hệ số aCu + bH2SO4 → cCuSO4 + dSO2 + eH2O
Bước 2: Ta lập hệ phương trình dựa trên nguyên tắc định luật bảo toàn khối lượng, khối lượng nguyên tử của mỗi nguyên tố ở 2 vế phải bằng nhau (VP = VT).
Số nguyên tử của Cu: a = c (1)
Số nguyên tử của S: b = c + d (2)
Số nguyên tử của H: 2b = 2e (3)
Số nguyên tử của O: 4b = 4c + 2d + e (4)
Bước 3: Giải hệ phương trình bằng cách
– Từ pt (3), chọn e = b = 1 (có thể chọn bất kỳ hệ số khác).
- Từ pt (2), (4) và (1) → c = a = d = ½ → c = a = d = 1; e = b =2 (quy đồng khử mẫu).
Bước 4: Đưa các hệ số vừa tìm vào phương trình phản ứng, ta được phương trình hoàn chỉnh.
Cu + 2H2SO4 đặc, nóng → CuSO4 + SO2 + 2H2O
⇒ Phương trình phản ứng hoàn thành, số nguyên tử mỗi nguyên tố VT = VP
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Chọn hệ số và CTHH thích hợp đặt vào những chỗ có dấu chấm hỏi trong các phương trình hóa học sau:
a. ? Na + ? → 2 Na2O
b. ? CuO + ?HCl → CuCl2 + ?
c. Al2(SO4)3 + ? BaCl2 → ? AlCl3 + ?
d. ? Al(OH)3 → Al2O3 + ?
Câu 2: Chọn hệ số và CTHH thích hợp đặt vào những chỗ có dấu chấm hỏi trong các phương trình hóa học sau:
a. ? CaO + ? HCl → CaCl2 + ?
b. ?Al + ? → 2Al2O3
c. FeO + CO → ? + CO2
d. ?Al + ?H2SO4 → Al2(SO4)3 + ?H2
Câu 3: Lập các PTHH sau và cho biết tỉ lệ số nguyên tử / phân tử của chất phản ứng với sản phẩm.
a. CuO + Cu → Cu2O
b. FeO + O2 → Fe2O3
c. Fe + HCl → FeCl2 + H2
d. Na + H2SO4 → Na2SO4 + H2
Câu 4: Lập PTHH của các phản ứng sau:
a. Photpho + Khí oxi → Photpho(V) oxit (P2O5)
b. Khí hidro + oxit sắt từ (Fe3O4) → Sắt + Nước (H2O)
c. Canxi + axit photphoric (H3PO4) → Canxi photphat (Ca3(PO4)2) + khí hidro
d. Canxi cacbonat (CaCO3) + axit clohidric (HCl) → Canxi clorua (CaCl2)+ nước + khí cacbonic
Câu 5: Cho kim loại nhôm tác dụng với axit sunfuric (H2SO4) tạo ra khí hidro (H2) và hợp chất nhôm sunfat Al2(SO4)3.
a. Lập PTHH.
b. Cho biết tỉ lệ nguyên tử nhôm Al lần lượt với ba chất còn lại trong phản ứng hóa học.
3.2. Bài tập trắc nghiệm
Câu 1: Chọn đáp án đúng
A. Phương trình hóa học biểu diễn ngắn gọn phản ứng hóa học
B. Có 2 bước để lập phương trình hóa học
C. Chỉ duy nhất 2 chất tham gia phản ứng tạo thành 1 chất sản phẩm mới gọi là phương trình hóa học
D. Quỳ tím dùng để xác định chất không là phản ứng hóa học
Câu 2: Chọn đáp án sai
A. Có 3 bước lập phương trình hóa học
B. Phương trình hóa học biểu diễn ngắn gọn phản ứng hóa học
C.Dung dich muối ăn có CTHH là NaCl
D.Ý nghĩa của phương trình hóa học là cho biết nguyên tố nguyên tử
Câu 3: Viết phương trình hóa học của kim loại sắt tác dụng với dung dịch axit sunfuric loãng biết sản phẩm là sắt (II) suafua và có khí bay lên
A. Fe + H2SO4 → FeSO4 + H2
B. Fe + H2SO4 → Fe2SO4 + H2
C.Fe + H2SO4 → FeSO4 + S2
D.Fe + H2SO4 → FeSO4 + H2S
Câu 4: CaCO3 + X → CaCl2 + CO2 + H2O. X là?
A. HCl
B. Cl2
C. H2
D. HO
Câu 5: Tỉ lệ hệ số tương ứng của chất tham gia và chất tạo thành của phương trình sau: Fe + 2HCl → FeCl2 + H2
A. 1:2:1:2
B. 1:2:2:1
C. 2:1:1:1
D. 1:2:1:1
4. Kết luận
Sau bài học cần nắm:
- Kĩ năng lập phương trình hoá học khi biết các chất phản ứng (tham gia) và sản phẩm
- Xác định được ý nghĩa của một số phương trình hoá học cụ thể.
Tham khảo thêm
- doc Hoá học 8 Bài 12: Sự biến đổi chất
- doc Hoá học 8 Bài 13: Phản ứng hóa học
- doc Hoá học 8 Bài 14: Bài thực hành 3
- doc Hoá học 8 Bài 15: Định luật bảo toàn khối lượng
- doc Hoá học 8 Bài 17: Bài luyện tập 3



