Hoá học 8 Bài 30: Bài thực hành 4
Qua bài học ở bài oxi. Các em đã biết tính chất của oxi. Để điều chế khí ôxi như thế nào? Và tính chất hoá học ra sao? Tiết học này các em sẽ tìm hiểu qua bài thực hành.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Mục đích thí nghiệm
- Điều chế và thử tính chất của oxi
- Nắm được các kỹ năng cơ bản trong phòng thí nghiêm
- Rèn luyện kỹ năng viết báo cáo thực hành
1.2. Kỹ năng thí nghiệm
- Khi điều chế oxi, miệng ống nghiệm phải hơi thấp xuống dưới.
+ Ống dẫn khí đặt gần đáy ống nghiệm thu khí oxi.
+ Dùng đèn cồn đun nóng đều ống nghiệm trước khi đun tập trung vào 1 chỗ.
+ Khi thu oxi bằng cách đẩy nước, cần rút ống dẫn khí ra khỏi chậu nước trước khi tắt đèn cồn.
- Khi tiến hành thí nghiệm đốt lưu huỳnh.
+ Dùng muôi sắt lấy 1 ít S bột.
+ Đốt muôi sắt chứa S trong không khí và nhanh chóng đưa muôi sắt vào trong lọ chứa khí oxi.
1.3. Cơ sở lý thuyết
a. Thí nghiệm 1: Điều chế và thu khí oxi
Phương trình phản ứng: 2KClO3 → 2KCl + O2
b. Thí nghiệm 2: đốt cháy lưu huỳnh trong không khí và trong oxi
Phương trình phản ứng: S + O2 → SO2
1.4. Dụng cụ thí nghiệm, hóa chất
a. Dụng cụ thí nghiệm
- Ống nghiệm, giá đỡ, đèn cồn, bông, ống dẫn khí....
- Muỗng sắt, bình thủy tinh có nắp…
b. Hóa chất
- KMnO4
- Bột lưu huỳnh, khí oxi,…
1.5. Các bước tiến hành thí nghiệm
a. Thí nghiệm 1: Điều chế và thu khí oxi
Lắp dụng cụ như hình vẽ
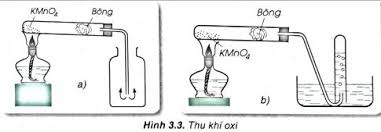
Cho một lượng nhỏ (bằng hạt ngô) KMnO4 vào đáy ống nghiệm. Đặt một ít bồng gần miệng ống nghiệm.
Dùng nút cao su có ống dẫn khí xuyên qua đậy kín ống nghiệm. Đặt ống nghiệm vào giá đỡ hoặc kẹp gỗ sao cho đáy ống nghiệm cao hơn miệng ống nghiệm chút ít.
Nhánh dài của ống dẫn khí sâu gần sát đáy ống nghiệm (hoặc lọ thu).
Dùng đèn cồn đun nóng cả ống nghiệm chứa KMnO4, sau đó tập trung đốt nóng phần có hóa chất. Kali pemanganat bị phân hủy tạo ra khí oxi. Nhận ra khí trong ống nghiệm (2) bằng que đóm còn hồng.
Sau khi kiểm tra độ kín của các nút, đốt nóng ống nghiệm chứa KMnO4. Khí oxi sinh ra sẽ đẩy không khí hoặc đẩy nước và chứa trong ống nghiệm thu. Dùng nút cao su đậy kín ống nghiệm đã chứa đẩy bình oxi để dùng cho thí nghiệm sau.
b. Thí nghiệm 2: Đốt cháy lưu huỳnh trong không khí và trong oxi
Chuẩn bị dụng cụ như hình vẽ
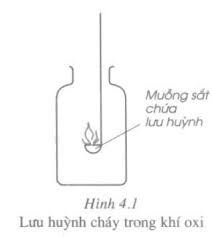
Cho vào muỗng sắt một lượng nhỏ (bằng hạt đậu xanh) lưu huỳnh S bột.
Đưa muỗng sắt có chứa lưu huỳnh vào ngọn lửa đèn cồn cho lưu huỳnh cháy trong không khí, sau đó đưa lưu huỳnh đang cháy vào lọ (hoặc ống nghiệm) chứa đầy khí oxi.
2. Báo cáo thí nghiệm
2.1. Thí nghiệm 1: Điều chế và thu khí oxi
- Hiện tượng: Có khí không màu thoát ra. Khi thử khí bằng tàn đóm, que đóm bùng cháy.
- Giải thích: Xảy ra phương trình phản ứng 2KClO3 → 2KCl + O2. Khí không màu sinh ra chính là khí Oxi. Vì khí oxi là khí duy trì sự sống và sự cháy nên khi thử khí bằng tàn đóm, que đóm bùng cháy.
2.2. Thí nghiệm 2: Đốt cháy lưu huỳnh trong không khí và trong oxi
- Hiện tượng: Lưu huỳnh cháy trong khí oxi mãnh liệt hơn cháy trong không khí, cho ngọn lửa màu xanh.
- Giải thích: Do lưu huỳnh cháy trong oxi tạo thành lưu huỳnh đioxit (SO2), còn gọi là khí sunfurơ) và rất ít lưu huỳnh trioxit (SO3)
- Phương trình phản ứng: S + O2 → SO2
3. Luyện tập
Câu 1: Nhiệt phân hoàn toàn 12,25 gam
A. 1,12 lít
B. 2,24 lít
C. 3,36 lít
D. 4,48 lít
Câu 2: Muốn điều chế được 2,8 lít (đktc) khí
A. 39,5g
B. 40,5g
C. 41,5g
D. 42,2g
Câu 3: Để có oxi tác dụng đủ với 7,2 gam cacbon thì khối lượng
A. 49 gam
B. 48 gam
C. 47 gam
D. 46 gam
Câu 4: Để có 6,4 gam oxi thì thể tích nước cần phải điện phân là:
A. 6,2 ml
B. 7,2 ml
C. 8,2 ml
D. 9,2 ml
4. Kết luận
Qua bài học các em nắm được:
- Tính chất vật lí của oxi.
- Để điều chế khí ôxi như thế nào?
- Và tính chất hoá học ra sao?
Tham khảo thêm
- doc Hoá học 8 Bài 24: Tính chất của oxi
- doc Hoá học 8 Bài 25: Sự oxi hóa - Phản ứng hóa hợp - Ứng dụng của oxi
- doc Hoá học 8 Bài 26: Oxit
- doc Hoá học 8 Bài 27: Điều chế khí oxi - Phản ứng phân hủy
- doc Hoá học 8 Bài 28: Không khí - sự cháy
- doc Hoá học 8 Bài 29: Bài luyện tập 5



