Hoá học 8 Bài 33: Điều chế khí hiđro - Phản ứng thế
Trong phòng thí nghiệm và trong công nghiệp nhiều lúc người ta cần tới khí Hiđro. Làm thế nào để điều chế của khí Hiđro? Phản ứng điều chế khí hiđro thuộc loại phản ứng nào? Chúng ta cùng nhau tìm hiểu nội dung bài giảng Điều chế khí hiđro - Phản ứng thế.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Điều chế H2
a. Trong phòng thí nghiệm
Cách tiến hành
- Nguyên liệu thường được dùng để điều chế H2 trong phòng thí nghiệm là axit HCl và kim loại Zn.
- Cho viên kẽm vào dung dịch axit HCl
Video 1: Phản ứng điều chế khí H2 từ phản ứng của Zn và Axit HCl
Hiện tượng - Giải thích
Hiện tượng:
+ Khi cho viên kẽm vào dung dịch axit HCl → dung dịch sôi lên và có khí thoát ra, viên kẽm tan dần.
+ Sau khi phản ứng kết thúc, lấy 1-2 giọt dung dịch trong ống nghiệm đem cô cạn → thu được chất rắn màu trắng.
Giải thích: Phương trình hóa học: Zn + 2HCl → ZnCl2 + H2
Kết luận
- Để điều chế H2 trong phòng thí nghiệm người ta có thể thay dung dịch axit HCl bằng H2SO4 loãng và thay Zn bằng Fe, Al, …
-Ống nghiệm vừa tiến hành thí nghiệm nóng lên rất nhiều chứng tỏ phản ứng xảy ra là phản ứng toả nhiệt.
- Khí H2 ít tan trong nước và nhẹ hơn không khí nên ta có thể thu H2 theo 2 cách: Đẩy nước và đẩy không khí.
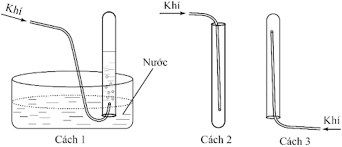
- Khi thu O2 bằng cách đẩy không khí người ta phải chú ý để miệng bình hướng lên trên, vì O2 nặng hơn không khí.
⇒ Vậy khi thu H2 bằng cách đẩy không khí ta phải hướng miệng ống nghiệm xuống dưới vì khí H2 nhẹ hơn không khí.
b. Trong công nghiệp
Video 2: Thí nghiệm điện phân nước để điều chế Oxi, Hidro
- Người ta điều chế H2 bằng cách điện phân nước hoặc dùng than khử oxi của H2O trong lò khí than hoặc điều chế H2 từ khí thiên nhiên, khí dầu mỏ
- Ví dụ:
1.2. Phản ứng thế là gì?
Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của 1 nguyên tố trong hợp chất.
2. Bài tập minh họa
2.1. Dạng 1: Phân loại phản ứng
Bài 1: Trong những phản ứng sau, phản ứng nào là phản ứng thế? Hãy giải thích sự lựa chọn đó?
a. 2Mg + O2 → 2MgO
b. KMnO4 → K2MnO4+MnO2+O2
c. Fe + CuCl2 → FeCl2 + Cu
d. Mg(OH)2 → MgO + H2O
e. Fe2O3 + H2 → Fe + H2O
f. Cu + AgNO3 → Ag + Cu(NO3)2
Hướng dẫn giải
Phản ứng thế là: c ; e ; g vì các nguyên tử của đơn chất (Fe , H2 , Cu) đã thay thế nguyên tử của 1 nguyên tố trong hợp chất (CuCl2 ; Fe2O3 ; AgNO3).
2.2. Dạng 2: Phương pháp điều chế Hidro
Khi thu khí oxi vào ống nghiệm bằng cách dẩy không khí, phải để vị trí ống nghiệm như thế nào? Vì sao? Đối với khí hiđro, có làm thế được không? Vì sao?
Hướng dẫn giải
Vì khí O2 (M = 32) nặng hơn không khí (M = 29) nên khi thu khí oxi ta có thế’ để ống nghiệm nghiêng hoặc để đứng, còn khí H2 nhẹ hơn không khí nên khi thu khí H2 phải úp ngược ống nghiệm, không được để đứng ống nghiệm.
2.3. Dạng 3: Xác định thể tích khí Hidro
Bài 1: Cho 22,4g sắt tác dụng với dung dịch loãng có chứa 24,5g axit sunfuric.
a) Chất nào còn dư sau phản ứng và dư bao nhiêu gam?
b) Tính thể tích khí hiđro thu được ở dktc.
Hướng dẫn giải
nFe = 22,4 / 56 = 0,4 mol
nH2SO4 = 24,5 / 98 = 0,25 mol
a) Phương trình hoá học của phản ứng
Fe + H2SO4 → FeSO4 + H2
1 mol 1 mol
So sánh tỉ lệ: (0,4/1) > (0,25/1) → khối lượng Fe dư.
mFe dư: (0,4 – 0,25).56 = 8,4g.
b) Theo phương trình phản ứng trên:
Do khối lượng Fe dư nên tính thể tích khí H2 theo số mol H2SO4
VH2 = 0,25.22,4 = 5,6 lít.
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Cho 6,5g Zn phản ứng với axit clohidric thấy có khí bay lên với thể tích là?
Câu 2: Cho một thanh sắt nặng 5,53g vào bình đựng dung dịch axit clohidric loang thu được dung dịch A và khí bay lên. Cô cạn dung dịch A được m (g) chất rắn. Hỏi dung dịch A là gì và tìm m?
Câu 3: Tính khối lượng ban đầu của Al khi cho phản ứng với axit sunfuric thấy có 1,68(l) khí thoát ra.
Câu 4: Điện phân hoàn toàn 2 lít nước ở trạng thái lỏng (biết khối lượng riêng D của nước là 1 kg/lít), thể tích khí hiđro và thể tích khí oxi thu được (ở đktc) lần lượt là?
Câu 5: Người ta cho kẽm hoặc sắt tác dụng với dung dịch axit clohiđric HCl để điều chế khí hiđro. Nếu muốn điều chế 2,24 lít khí hiđro (đktc) thì phải dùng số gam kẽm hoặc sắt lần lượt là?
3.2. Bài tập trắc nghiệm
Câu 1: Chọn đáp án đúng:
A. Phản ứng giữa Fe và HCl là phản ứng OXH – Khử
B. Phản ứng thế là phản ứng giữa hợp chất và hợp chất
C. CaCO3 −to→ CaO + CO2 là phản ứng khử
D. Khí H2 nặng hơn không khí
Câu 2: Cho Al tác dụng tác dụng với H2SO4 loãng tạo ra mấy sản phẩm
A. 1
B. 2
C. 3
D. 4
Câu 3: Điều chế Hidro trong công nghiệp, người ta dùng:
A. Cho Zn + HCl
B. Fe + H2SO4
C. Điện phân nước
D. Khí dầu hỏa
Câu 4: Sau phản ứng Zn và HCl trong phòng thí nghiệm, đưa que đóm đang cháy vào ống dẫn khí , khí thoát ra cháy được trong không khí với ngọn lửa màu gì?
A. Đỏ
B. Xanh nhạt
C. Cam
D. Tím
Câu 5: Chọn đáp án sai:
A. Kim loại dùng trong phòng thí nghiệm phản ứng với HCl hoặc H2SO4 loãng là Na
B. Hidro ít tan trong nước
C. Fe
D. Fe + 2HCl → FeCl2 + H2
4. Kết luận
Sau bài học cần nắm:
- Cách điều chế H2 trong phòng thí nghiệm và trong công nghiệp
- Khái niệm phản ứng thế.
Tham khảo thêm
- doc Hoá học 8 Bài 31: Tính chất - Ứng dụng của hiđro
- doc Hoá học 8 Bài 32: Phản ứng oxi hóa - khử
- doc Hoá học 8 Bài 34: Bài luyện tập 6
- doc Hoá học 8 Bài 35: Bài thực hành 5
- doc Hoá học 8 Bài 36: Nước
- doc Hoá học 8 Bài 37: Axit Bazơ Muối
- doc Hoá học 8 Bài 38: Bài luyện tập 7
- doc Hoá học 8 Bài 39: Bài thực hành 6



