Giải bài tập SBT Hóa 9 Bài 19: Sắt
Dưới đây là nội dung chi tiết Giải bài tập SBT Hóa 9 Chương 2 Sắt với hướng dẫn giải chi tiết, rõ ràng, trình bày khoa học. eLib hy vọng đây sẽ là tài liệu hữu ích giúp các bạn học sinh lớp 9 học tập thật tốt
Mục lục nội dung
1. Giải bài 19.1 trang 23 SBT Hóa học 9
2. Giải bài 19.2 trang 23 SBT Hóa học 9
3. Giải bài 19.3 trang 24 SBT Hóa học 9
4. Giải bài 19.4 trang 24 SBT Hóa học 9
5. Giải bài 19.5 trang 24 SBT Hóa học 9
6. Giải bài 19.6 trang 24 SBT Hóa học 9
7. Giải bài 19.7 trang 24 SBT Hóa học 9
8. Giải bài 19.8 trang 24 SBT Hóa học 9
9. Giải bài 19.9 trang 24 SBT Hóa học 9
10. Giải bài 19.10 trang 24 SBT Hóa học 9
11. Giải bài 19.11 trang 24 SBT Hóa học 9
12. Giải bài 19.12 trang 25 SBT Hóa học 9

1. Giải bài 19.1 trang 23 SBT Hóa học 9
Muối Fe (III) được tạo thành khi cho Fe tác dụng với dung dịch
A. HNO3 (loãng, dư)
B. H2SO4 loãng
C. HCl
D. CuSO4
Phương pháp giải
Sắt có những tính chất của kim loại
- Tác dụng với nhiều phi kim tạo thành oxit sắt hoặc muối
- Tác dụng với dung dịch axit tạo thành muối sắt (II) và giải phóng H2.
- Tác dụng với dung dịch muối của kim loại yếu tạo thành muối sắt (II).
Hướng dẫn giải
Muối Fe (III) được tạo thành khi cho Fe tác dụng với dung dịch HNO3 (loãng, dư)
Đáp án A.
2. Giải bài 19.2 trang 23 SBT Hóa học 9
Cho các kim loại: Ni, Fe, Cu, Zn, số kim loại tác dụng được với dung dịch Pb(NO3)2 là
A. 1
B. 2
C. 3
D. 4
Phương pháp giải
Dựa vào dãy hoạt động hóa học của kim loại để giải bài tập này
Hướng dẫn giải
Ni + Pb(NO3)2 → Ni(NO3)2 + Pb
Fe + Pb(NO3)2 → Fe(NO3)2 + Pb
Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
Đáp án cần chọn là C.
3. Giải bài 19.3 trang 24 SBT Hóa học 9
Dung dịch FeSO4 và dung dịch CuSO4 đều tác dụng được với kim loại
A. Ag
B. Fe
C. Cu
D. Zn
Phương pháp giải
Dựa vào dãy hoạt động hóa học của kim loại để giải bài tập này
Hướng dẫn giải
Zn + FeSO4 → ZnSO4 + Fe
Zn + CuSO4 → ZnSO4 + Cu
→ Đáp án D.
4. Giải bài 19.4 trang 24 SBT Hóa học 9
a) Tại sao những kim loại như sắt, nhôm không có ở dạng đơn chất trong vỏ Trái Đất ?
b) Hãy nêu phương pháp hoá học để nhận biết ba kim loại: sắt, nhôm và đồng. Viết các phương trình hoá học.
Phương pháp giải
Xem lại tính chất hóa học của Al, Fe và Cu và sự khác nhau giữa chúng.
Hướng dẫn giải
a) Al, Fe là kim loại hoạt động hoá học mạnh nên chúng chỉ tồn tại dưới dạng hợp chất.
b) Dùng dung dịch kiềm (thí dụ NaOH):
- Cho 3 kim loại tác dụng với dung dịch NaOH, kim loại nào tác dụng với NaOH cho khí H2 bay ra là Al.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
- Cho 2 kim loại còn lại tác dụng với dung dịch HCl, kim loại nào cho khí H2 bay ra là Fe, còn Cu không phản ứng.
Fe + 2HCl → FeCl2 + H2
5. Giải bài 19.5 trang 24 SBT Hóa học 9
Ở Việt Nam có những loại quặng sắt nào? Viết công thức hoá học và cho biết địa điểm của những loại quặng đó.
Phương pháp giải
Để giải bài tập này cần nắm vững lý thuyết về sắt
Hướng dẫn giải
Ở Việt Nam có loại quặng hematit (Fe2O3) ở Trại Cau, tỉnh Thái Nguyên.. Vì vậy, nước ta đã xây dựng khu công nghiệp gang - thép ở Thái Nguyên...
6. Giải bài 19.6 trang 24 SBT Hóa học 9
Viết các phương trình hoá học thực hiện dãy chuyển đổi hoá học sau:
a) Fe → FeCl3 → Fe(OH)3 → Fe2O3 → Fe2(SO4)3
b) Fe → FeCl2 → Fe(OH)2 → FeSO4 → Fe
Phương pháp giải
Xem lại tính chất hóa học của Fe và các hợp chất vô cơ liên quan đến sắt.
Hướng dẫn giải
a)
(1) 2Fe + 3Cl2 to → 2FeCl3
(2) FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
(3) 2Fe(OH)3 → Fe2O3 + 3H2O
(4) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
b)
(5) Fe + 2HCl → FeCl2 + H2
(6) FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
(7) Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
(8) FeSO4 + Zn → ZnSO4 + Fe
7. Giải bài 19.7 trang 24 SBT Hóa học 9
Có hỗn hợp bột kim loại gồm sắt và đồng. Trình bày phương pháp tách riêng mỗi kim loại.
Phương pháp giải
Xem lại tính chất hóa học khác nhau giữa Fe và Cu để tách riêng từng kim loại.
Hướng dẫn giải
Cho hỗn hợp bột kim loại sắt và đồng vào dung dịch HCl, đồng không tác dụng. Đem lọc hỗn hợp sau phản ứng, ta được đồng và dung dịch nước lọc.
Cu + HCl → không phản ứng.
Fe + 2HCl → FeCl2 + H2
Cho Zn vào dung dịch nước lọc, sau phản ứng thu được Fe :
Zn + FeCl2 → ZnCl2 + Fe
8. Giải bài 19.8 trang 24 SBT Hóa học 9
Cho các kim loại sau: đồng, sắt, nhôm, bạc. Cho biết các kim loại thoả mãn những trường hợp sau:
a) Không tan trong dung dịch axit clohiđric và dung dịch axit suníuric loãng.
b) Tác dụng được với dung dịch axit và dung dịch kiềm.
c) Đẩy được đồng ra khỏi dung dịch muối đồng.
Phương pháp giải
Xem lại tính chất hóa học của kim loại
Xem lại dãy hoạt động hóa học của kim loại
Hướng dẫn giải
a) Đồng, bạc không tan trong dung dịch HCl và dung dịch H2SO4 loãng.
b) Nhôm tan được trong dung dịch axit và dung dịch kiềm.
2Al + 6HCl → 2AlCl3 + 3H2
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
c) Sắt và nhôm đẩy được đồng ra khỏi dung dịch muối đồng:
Fe + CuSO4 → FeSO4 + Cu
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
9. Giải bài 19.9 trang 24 SBT Hóa học 9
Cho 7,2 gam một oxit sắt tác dụng với dung dịch axit HCl có dư. Sau phản ứng thu được 12,7 gam một muối khan. Tim công thức oxit sắt đó.
Phương pháp giải
Đặt công thức tổng quát của oxit sắt, viết và biện luận theo phương trình hóa học.
Hướng dẫn giải
Ta có:
FexOy + 2yHCl → xFeCl2y/x + yH2O
Theo phương trình: (56x + 16y) gam cho (56x + 71y) gam muối
Theo đề bài: 7,2 gam cho 12,7 gam
Giải ra, ta có: x/y = 1/1.
Công thức oxit sắt là FeO.
10. Giải bài 19.10 trang 24 SBT Hóa học 9
Hoà tan hoàn toàn 0,56 gam sắt bằng dung dịch H2SO4 loãng 19,6% vừa đủ.
a) Viết phương trình hoá học
b) Tính khối lượng muối tạo thành và thể tích khí hiđro sinh ra (đktc).
c) Cần bao nhiêu gam dung dịch H2SO4 loãng nói trên để hoà tan sắt?
Phương pháp giải
Tính toán dựa vào phương trình hóa học.
Hướng dẫn giải
a) Fe + H2SO4 → FeSO4 + H2
b) nFe = 0,56 : 56 = 0,01 mol
nFeSO4 = nFe = 0,01
Khối lượng muối FeSO4 tạo thành là: 0,01 x 152 = 1,52 (gam).
Thể tích khí hiđro sinh ra: 0,01 x 22,4 = 0,224 (lít).
11. Giải bài 19.11 trang 24 SBT Hóa học 9
Cho lá sắt có khối lượng 5,6 gam vào dung dịch đồng sunfat. Sau một thời gian, nhấc lá sắt ra, rửa nhẹ, làm khô và cân thấy khối lượng lá sắt là 6,4 gam. Khối lượng muối sắt được tạo thành là
A. 30,4 gam
B. 15,2 gam
C. 12,5 gam
D. 14,6 gam
Phương pháp giải
Áp dụng phương pháp tăng giảm khối lượng.
Hướng dẫn giải
Fe + CuSO4 → FeSO4 + Cu
1 mol Fe sau phản ứng tạo 1 mol Cu khối lượng tăng lên 8g
0,1 mol Fe sau phản ứng tạo 0,1 mol Cu khối lượng tăng lên 0,8g
mFeSO4 = 0,1 x 152 = 15,2g
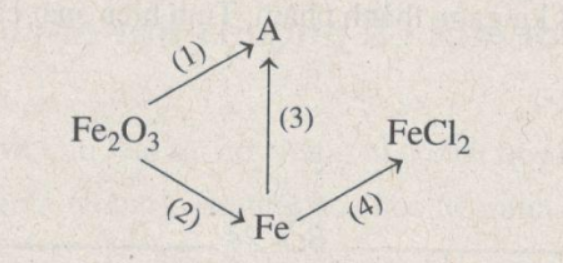
12. Giải bài 19.12 trang 25 SBT Hóa học 9
Hoàn thành sơ đồ phản ứng sau:
Phương pháp giải
Xem tính chất hóa học của Fe và hợp chất của sắt.
Hướng dẫn giải
(1) Fe2O3 + 6HCl → 2FeCl3 + 3H2O
(2) Fe2O3 + H2 → 2Fe + 3H2O
(3) 2Fe + 3Cl2 → 2FeCl3
(4) Fe + 2HCl → FeCl2 + H2
13. Giải bài 19.13 trang 25 SBT Hóa học 9
Cho m gam hỗn hợp Fe và Zn tác dụng vừa hết với 1 lít dung dịch HCl 2,5M (D = 1,19 g/ml) thấy thoát ra một chất khí và thu được 1200 gam dung dịch. Xác định giá trị của m.
Phương pháp giải
Viết phương trình hóa học, nhận xét quan hệ số mol HCl và số mol khí, áp dụng định luật bảo toàn khối lượng tính m.
Hướng dẫn giải
Ta có:
mdd HCl = 1000.1,19 = 1190 g
Áp dụng định luật bảo toàn khối lượng ta có:
mhh + 1190 = 1200 + mH2Phương trình hóa học của phản ứng:
Zn + 2HCl → ZnCl2 + H2
Fe + 2HCl → FeCl2 + H2
Qua phương trình hóa học trên, ta nhận thấy:
nH2 = 1/2nHCl; nH2 = 2,5/2 = 1,25 mol
mhh = 1200 - 1190 +(1,25x2) = 12,5g
14. Giải bài 19.14 trang 25 SBT Hóa học 9
Cho hai mẩu Fe có khối lượng bằng nhau. Cho một mẩu hoà tan hoàn toàn trong dung dịch HCl tạo 19,05 gam muối. Cho mẩu còn lại tan hoàn toàn trong dung dịch H2SO4 loãng thì khối lượng muối sunfat tạo ra là bao nhiêu ?
Phương pháp giải
Tính số mol Fe trong từ mẩu thông qua khối lượng muối clorua. Qua đó, tính được khối lượng muối sunfat.
Hướng dẫn giải
Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2
Fe + H2SO4 → FeSO4 + H2
Qua các phương trình hóa học trên và dữ liệu đề bài, ta có:
nFeCl2 = 19,05/127 = 0,15 mol = nFe
mFeSO4 = 0,15 x 152 = 22,8g
Tham khảo thêm
- doc Giải bài tập SBT Hóa 9 Bài 15: Tính chất vật lí của kim loại
- doc Giải bài tập SBT Hóa 9 Bài 16: Tính chất hóa học của kim loại
- doc Giải bài tập SBT Hóa 9 Bài 17: Dãy điện hóa của kim loại
- doc Giải bài tập SBT Hóa 9 Bài 18: Nhôm
- doc Giải bài tập SBT Hóa 9 Bài 20: Hợp kim sắt: Gang, thép
- doc Giải bài tập SBT Hóa 9 Bài 21: Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn
- doc Giải bài tập SBT Hóa 9 Bài 22: Luyện tập chương 2: Kim loại