Giải bài tập SGK Hóa 11 Nâng cao Bài 60: Cấu trúc, danh pháp, tính chất vật lí Axit cacboxylic
Dưới đây là nội dung chi tiết Giải bài tập nâng cao Hóa 11 Chương 9 Bài 60, với hướng dẫn giải chi tiết, rõ ràng, trình bày khoa học. eLib hy vọng đây sẽ là tài liệu hữu ích giúp các bạn học sinh lớp 11 học tập thật tốt!
Mục lục nội dung

1. Giải bài 1 trang 250 SGK Hóa 11 nâng cao
Hãy điền chữ Đ (đúng) hoặc S (sai) vào dấu [... ] ở mỗi câu sau:
a) Axit cacbonic có nhóm cacboxyl. [... ]
b) Axit cacbonic là axit cacboxylic. [... ]
c) Axit cacboxylic no là axit không chứa liên kết bội. [... ]
d) Axit cacboxylic không no là axit có chứa liên kết C = C hoặc C ≡ C. [... ]
Phương pháp giải
- Axit cacboxylic là hợp chất hữu cơ mà phân tử có nhóm cacboxyl (-COOH) liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hiđro.
- Nhóm 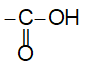 được gọi là nhóm cacboxyl, viết gọn là -COOH.
được gọi là nhóm cacboxyl, viết gọn là -COOH.
Hướng dẫn giải
a) Đúng
b) Sai
c) Sai
d) Đúng
2. Giải bài 2 trang 250 SGK Hóa 11 nâng cao
a) Axit cacboxylic là gì? Phân loại axit cacboxylic theo cấu tạo gốc hiđrocacbon.
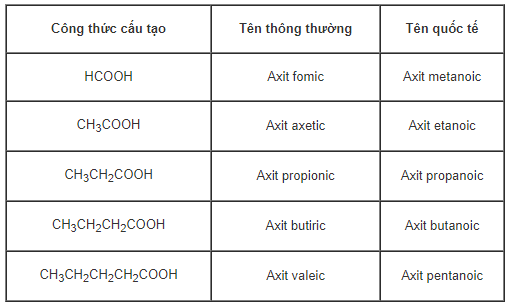
b) Viết công thức cấu tạo chung cho dãy axit no đơn chức, mạch hở. Gọi tên thông thường và tên quốc tế của 5 thành viên đầu của dãy với mạch cacbon không phân nhánh.
Phương pháp giải
- Axit cacboxylic là hợp chất hữu cơ mà phân tử có nhóm cacboxyl (-COOH) liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hiđro.

Hướng dẫn giải
Câu a:
Axit cacboxylic là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl (-COOH) liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hidro.
Có bốn loại: axit no, axit không nó, axit htowm, và axit đa chức.
Câu b: Công thức chung của axit nó đơn chức: CnH2n+1COOH (n≥0).
3. Giải bài 3 trang 251 SGK Hóa 11 nâng cao
Viết công thức cấu tạo và gọi tên thay thế các axit đồng phân có công thức phân tử:
a) C5H10O2
b) C4H6O2
Phương pháp giải
Tên gọi = axit + tên hiđrocacbon no tương ứng với mạch chính + “oic”.
Hướng dẫn giải
Câu a: C5H10O2
CH3CH2CH2CH2COOH: axit pentanoic
CH3CH2CH(CH3)COOH: axit 2-metyl butanoic
CH3CH(CH3)CH2COOH: axit 3-metyl butanoic
(CH3)3C-COOH: axit 2,2-đimetyl propanoic
Câu b: C4H6O2
CH2=CHCH2COOH: axit but-3-enoic
CH3CH=CHCOOH: axit but-2-enoic
CH2=C(CH3)COOH: axit-2-metyl propenoic
4. Giải bài 4 trang 251 SGK Hóa 11 nâng cao
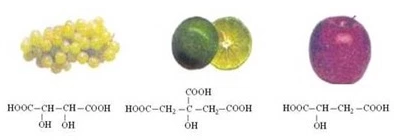
Vị chua của trái cây là do các axit hữu cơ có trong đó gây nên. Trong quả táo có axit 2-hidroxibutanđioic (axit malic), trong quả nho có axit -2,3- đi hidroxibutanđioic (axit tacric), trong quả chanh có axit 2- hidroxipropan -1, 2, 3 –tricacboxylic (axit xitri còn gọi là axit limonic). Hãy điền các tên dưới các công thức sau cho phù hợp.
Phương pháp giải
Tên gọi = axit + tên hiđrocacbon no tương ứng với mạch chính + “oic”.
Hướng dẫn giải
HOOC-CH(OH)-CH2-COOH : Axit 2 hidroxi butanđioic
HCOO-CH(OH)-CH(OH)-COOH: Axit -2,3-đi hidroxi butanđioic
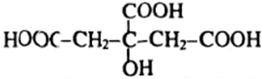 axit 2-hidroxi propan-1, 2, 3 - tricacboxylic
axit 2-hidroxi propan-1, 2, 3 - tricacboxylic
5. Giải bài 5 trang 251 SGK Hóa 11 nâng cao
Nêu đặc điểm cấu tạo và sự phân bố mật độ electron ở nhóm cacboxyl.
Giải thích:
a) Vì sao lực axit cacboxylic lớn hơn của phenol và ancol?
b) Vì sao nhiệt độ sôi và nhiệt độ nóng chảy của axit cao hơn so với của anđehit, xeton và ancol có cùng số nguyên tử C?
Phương pháp giải
- Nhóm –OH và nhóm >C=O lại có ảnh hưởng qua lại lẫn nhau
- Liên kết giữa H và O trong nhóm –OH phân cực mạnh, nguyên tử H linh động hơn trong ancol, anđehit và xeton có cùng số nguyên tử C.
- Nhiệt độ sôi tăng theo chiều tăng M và cao hơn các ancol có cùng M: nguyên nhân là do giữa các phân tử axit cacboxylic có liên kết hiđro bền hơn liên kết hidro giữa các phân tử ancol.
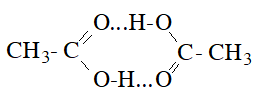
- Axit cacboxylic cũng tạo liên kết hiđro với nước và nhiều chất khác. Các axit fomic, axetic, propionic tan vô hạn trong nước. Khi số nguyên tử C tăng lên thì độ tan trong nước giảm.
Hướng dẫn giải
Câu a: Khả năng phân li cho proton H+ tùy thuộc vào sự phân cực của liê kết –O-H (xem SGK)
Các nhóm hút electron làm giảm mật độ electron trên nguyên tử O ⇒ làm tăng độ phân cực của liên kết – O- H ⇒ H linh động hơn ⇒ tính axit tăng.
Các nhóm đẩy electron làm tăng mật độ electron trên nguyên tử O ⇒ làm giảm độ phân cực của liên kết – O –H ⇒ H kém linh động hơn ⇒ tính xaait giảm
Dựa trên đặc điểm cấu tạo và sự phân bố mật độ electron, ta thấy liên kết – O –H trong phân tử axit phân cực nhất rồi đến phenol và cuối cùng là ancol etylic.
Câu b: Nhiệt độ sôi và nhiệt độ nóng chảy của axit cacboxylic cao hơn so với anđêhit, xeton và ancol có cùng số cacbon vì axit tạo được liên kết hidro liên phân tử bền vững hơn.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 58: Anđehit và xeton
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 59: Luyện tập Anđehit và xeton
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 61: TCHH, điều chế và ứng dụng Axit cacboxylic
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 62: Luyện tập Axit cacboxylic



